
【题目】从废旧锂离子二次电池(主要成分为![]() ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
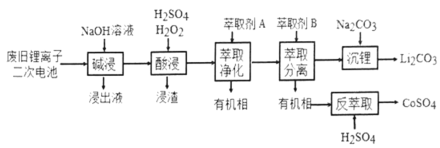
回答下列问题:
(1)“碱浸”目的是___________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
(3)“萃取净化”除去的杂质离子有![]() 外,还有__________。
外,还有__________。
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,pH一般选择5左右,理由是______________。

(5)“沉锂”中![]() 溶解度随温度变化曲线如下图所示:
溶解度随温度变化曲线如下图所示:
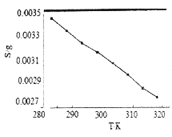
①根据平衡移动原理分析![]() 在水中溶解度随温度变化的原因____________________。
在水中溶解度随温度变化的原因____________________。
②为获得高纯![]() ,提纯操作依次为趁热过滤、________、烘干。
,提纯操作依次为趁热过滤、________、烘干。
【答案】除去铝 2LiCoO2+H2O2 +6H+=2Li++2Co2++O2↑+4H2O 石墨、硫酸钙 Fe3+ 分离效率最高 Li2CO3溶解过程为放热反应 洗涤
【解析】
根据流程和题意碱浸除去的是溶于碱溶液的铝;酸浸的目的是把+3价的钴还原为+2价,同时使Ca2+转化为硫酸钙和不溶的碳一起过滤除去;萃取净化的目的是除去镍和铁,萃取分离是分离锂和钴。
(1)“碱浸”的目的是用氢氧化钠溶液将其中的Al溶解,将Al除去;
(2)LiCoO2中Co为+3价,最后生成的CoSO4中Co为+2价,所以酸浸这一步中,加入H2O2的目的是为了将+3价Co还原为+2价Co,H2O2做还原剂,生成氧气,所以反应的离子反应方程式为:2 LiCoO2 + H2O2 + 6H+=2Li++2Co2+ + O2↑ + 4 H2O;浸渣中主要是不与酸反应的石墨以及生成的硫酸钙沉淀。
(3)整个提取的过程中需要除去的杂质是Ca、Fe、Al、Ni;在前面的步骤中已经除去了Al和Ca,所以萃取净化应该要除去Ni2+和Fe3+。
(4)由图示在pH为5左右的时候,Co和Li的萃取率差异最大,此时分离的效果最好。
(5)①图中显示随着温度升高,碳酸锂的溶解度逐渐减小,根据平衡移动的原理,温度升高,平衡向吸热方向进行,所以碳酸锂溶于水的过程是放热的。
②对物质进行提纯,在过滤和烘干之间,必须洗涤,以保证得到的物质纯度较高,所以答案为:洗涤。


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]22H2O (相对分子质量为376)是一种氧气吸收剂,为红棕色晶体,潮湿时易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
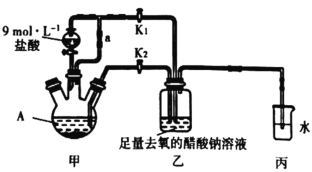
①________________________________________。
②往装置A中依次加入过量锌粒、适量CrCl3溶液。
③关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
④待A内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
⑤将装置乙中混合物快速过滤、洗涤和干燥,称量得到[Cr(CH3COO)2]22H2O。
(1)实验步骤①进行什么操作______________________________。
(2)装置A的名称__________________。
(3)写出装置A中反应的离子方程式为__________________,___________________________。
(4)实现步骤①中溶液自动转移至装置乙中的实验操作为__________________。
(5)步骤③目的是_____________________________________________。
(6)洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是__________________。
(7)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质12.68g,实验后得干燥纯净的[Cr(CH3COO)2]22H2O 11.28g,则该实验所得产品的产率为_______(不考虑溶解的醋酸亚铬水合物)(用百分数表示,保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
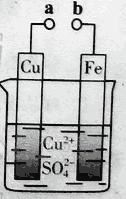
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 分子筛催化剂,
分子筛催化剂,![]() 可脱除燃煤烟气中的
可脱除燃煤烟气中的![]() 和
和![]() ,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
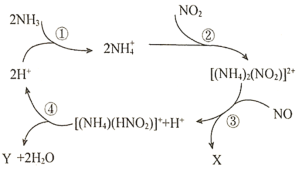
A.X和Y均是![]()
B.上述历程的总反应为:![]()
C.阶段④中氮元素只被还原
D.![]() 、
、![]() 、
、![]() 中的质子数、电子数均相同
中的质子数、电子数均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国广泛采用将干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,用其取代氯气对自来水消毒,从而降低自来水中的氯残留对人体健康的影响。
(1)在ClO2分子中氯元素的化合价是______________。
(2)表示这一反应的化学方程式是________________________________,和欧洲的方法相比,我国这一方法的主要优点是生产出的ClO2中不含Cl2杂质。
(3)在酸性溶液中,用草酸钠(Na2C2O4)还原NaClO3也可制得ClO2,表示这一反应的化学方程式是________________________________,此法的优点是ClO2可被CO2稀释(Na2C2O4的氧化产物是CO2)。
(4)根据上述原理,北京绿先锋环保科技有限责任公司生产的“绿先锋消毒剂”是由两组固体试剂组成的。其使用方法见下图:

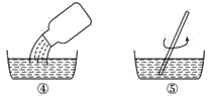
小瓶内盛的白色固体是________________,瓶胆内盛的白色固体是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组实验测得某硅酸盐所含氧化物的质量分数如下表:
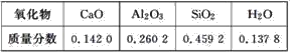
根据表中的数据请写出
(1)该硅酸盐的普通化学式是______________。
(2)用氧化物的形式表示该硅酸盐的组成是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是

A. 鲁米诺的化学式为C8H6N3O2
B. 1 mol A分子最多可以与5 mol氢气发生加成反应
C. B中处于同一平面的原子有9个
D. (1)、(2)两步的反应类型分别为取代反应和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol/(L·min)B.v(D)=1mol/(L·min)
C.v(C)=0.8mol/(L·min)D.v(B)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com