
【题目】利用![]() 分子筛催化剂,
分子筛催化剂,![]() 可脱除燃煤烟气中的
可脱除燃煤烟气中的![]() 和
和![]() ,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
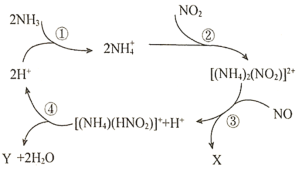
A.X和Y均是![]()
B.上述历程的总反应为:![]()
C.阶段④中氮元素只被还原
D.![]() 、
、![]() 、
、![]() 中的质子数、电子数均相同
中的质子数、电子数均相同
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应 2NO2(g) ![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数
D. CO2+H2![]() CO+H2O 的平衡常数表达式为 K =c(CO)/[c(CO2)c(H2)]
CO+H2O 的平衡常数表达式为 K =c(CO)/[c(CO2)c(H2)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是无色透明的晶体,易溶于水,其水溶液显碱性。在漂白工业中用作“脱氯剂”,常用黄铁矿(主要成分是![]() )经以下流程来制备硫代硫酸钠
)经以下流程来制备硫代硫酸钠
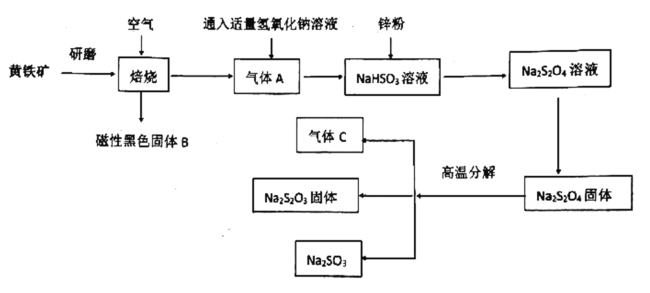
已知:气体C可以使品红溶液褪色
(1)研磨的目的是:____________,磁性黑色固体B的化学式为:________。
(2)尾气C能否用氢氧化钙溶液吸收:________(填“能”或“不能”),原因是:
________________。
(3)写出![]() 固体高温分解反应方程式:__________________________。
固体高温分解反应方程式:__________________________。
(4)![]() 溶液与盐酸不能稳定存在,用离子方程式解释不能存在的原因:
溶液与盐酸不能稳定存在,用离子方程式解释不能存在的原因:
____________________。
(5)请用“<”符号表示出亚硫酸氢钠溶液中的各离子浓度大小关系:____________。
(6)硫代硫酸钠在漂白工业中用作“脱氯剂”,标准状况下当消耗31.6g硫代硫酸钠时吸收氯气的积为:________L。
(7)已知![]() 溶液中
溶液中![]() ,求
,求![]() 的比值________(已知:
的比值________(已知:![]() 溶液的一级电离常数为
溶液的一级电离常数为![]() ,二级电离常数为
,二级电离常数为![]() ,水的电离常数为
,水的电离常数为![]() ,请用含有
,请用含有![]() 、
、![]() 、
、![]() 、b的式子表示)。
、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
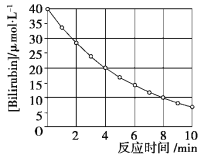
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种航天器能量储存系统原理示意图。下列说法正确的是
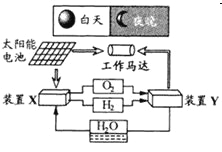
A. 该系统中只存在3种形式的能量转化
B. 装置Y中负极的电极反应式为:![]()
C. 装置X能实现燃料电池的燃料和氧化剂再生
D. 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用足量的MnO2和含有4 mol溶质的浓盐酸充分反应制氯气,下列说法正确的是( )
A. 该实验中共消耗1 mol MnO2,生成1 mol氯气
B. 为了除去氯气中混有的杂质气体,可以依次通过饱和食盐水和碱石灰
C. 在该反应中MnO2作氧化剂,浓盐酸作还原剂
D. 氯气可以用向上排空气法或排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为![]() ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
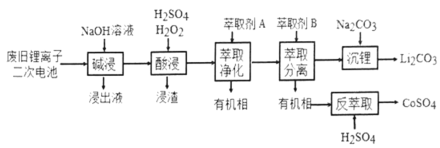
回答下列问题:
(1)“碱浸”目的是___________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
(3)“萃取净化”除去的杂质离子有![]() 外,还有__________。
外,还有__________。
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,pH一般选择5左右,理由是______________。

(5)“沉锂”中![]() 溶解度随温度变化曲线如下图所示:
溶解度随温度变化曲线如下图所示:
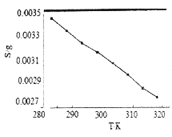
①根据平衡移动原理分析![]() 在水中溶解度随温度变化的原因____________________。
在水中溶解度随温度变化的原因____________________。
②为获得高纯![]() ,提纯操作依次为趁热过滤、________、烘干。
,提纯操作依次为趁热过滤、________、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入100g原粮,E中加入20.00mL 1.50×l0-3mol/L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)仪器D的名称是________________________。
(2)AlP与水反应的化学方程式为__________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸( )的碱性溶液,其作用是_____________________________。
)的碱性溶液,其作用是_____________________________。
(4)通入空气的作用是____________________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为______________。(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-4mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为______________, 则该原粮中磷化物(以PH3计)的含量为_____ mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
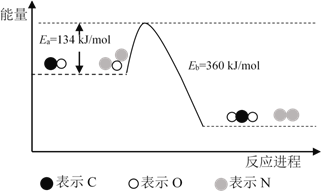
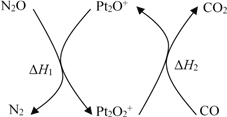
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com