
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可以表述为:
KClO3+ HCl(浓) → KCl+ ClO2↑+ Cl2↑+ H2O
(1)请完成该化学方程式并配平__________________
(2)浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量是为_________mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
【答案】 2 KClO3+ 4 HCl(浓) = 2 KCl+ 2 ClO2↑+ 1 Cl2↑+ 2 H2O ② 0.2 2.6
【解析】(1)KClO3中Cl元素化合价由+5价降为ClO2中+4价,化合价降1;HCl中Cl元素化合价由-1价升高为Cl2中0价,化合价升2,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;然后根据原子守配平其他物质的系数。
故答案为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O;
(2)2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中Cl元素化合价升高为Cl2,则HCl中氯元素被氧化;KCl中Cl-来自HCl,故HCl体现酸性。故选②;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol,故答案为:0.2mol;
(4)ClO2和Cl2作氧化消毒时,还原产物均为Cl-,1molCl2转移2mol电子,则单位质量的Cl2转移电子n=![]() =
=![]() mol;1molClO2转移5mol电子,则单位质量的ClO2转移电子数n=
mol;1molClO2转移5mol电子,则单位质量的ClO2转移电子数n=![]() =
=![]() mol;则ClO2消毒的效率是Cl2的倍数为
mol;则ClO2消毒的效率是Cl2的倍数为![]() ≈2.6。
≈2.6。
故答案为:2.6。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.分别测等浓度的醋酸和氨水pH,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等
B.将CH3COONa溶液从25℃升温至 40℃,溶液中 ![]() 增大
增大
C.向硝酸中加入氨水至中性,溶液中 ![]() <1
<1
D.向AgCl、AgBr 的饱和溶液中加入少量 AgNO3 , 溶液中 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关药品的保存和使用不正确的是( )
A.溴水盛于带磨砂玻璃塞的细口瓶中
B.硫酸铜粉末、氯化钙等药品应贮存于干燥器中
C.白磷浸入水中密封保存
D.用碳酸钠滴定未知浓度的盐酸,碳酸钠盛于酸式滴定管中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:①O2和O3 ②H2、D2、T2 ③12 C和14 C ④CH3CH2CH2CH3和(CH3)2CHCH3 ⑤癸烷和十六烷 ⑥CH3(CH2)5CH3和CH3CH2CH2CH(CH3)C2H5 ⑦ 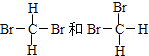 (在横线上填相应的序号) A、互为同位素的是; B、互为同分异构体的是;
(在横线上填相应的序号) A、互为同位素的是; B、互为同分异构体的是;
C、互为同素异形体的是; D、同一种物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z三种物质中含同种元素,在一定条件下可以实现如图所示转化,下列推断不正确的是( ) 
A.若Y为氧化铝,则Y 生成X的条件是“通电”
B.若X为硫单质,则Y 可能为硫化氢
C.若Z为硝酸,则X可能为一氧化氮
D.若Z为硝酸铁,则Y一定为铁单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A. NaH中H的化合价:-1
B. 小苏打的化学式:NaCO3
C. 氯离子的结构示意图
D. NaClO的电离方程式:NaClO=Na++Cl-+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中提取碘的一种流程如下:

(1) “操作Ⅰ”的主要目的的是获得含I-的溶液,它包括灼烧、水浸。其中灼烧时装置如右图所示,仪器A的名称为__。

(2)“置换”所得滤渣中含有Fe和Ag。
①使用化学方法分离出Ag操作是__。
②分离出的Ag用稀硝酸转化为AgNO3,以循环利用,相关离子方程式为__。
(3)“操作Ⅱ”得到水层的方法是:将通入Cl2后的溶液置于分液漏斗中,加入CC14,振荡静置,__。
(4)检验“操作Ⅱ”所得水层中是否含有Fe3+的方法是__。
【答案】 坩埚 将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤 3Ag+4H++NO![]() =3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
=3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
【解析】流程分析:海带中提碘的操作为,先灼烧海带,再水浸溶解,过滤除去不溶性杂质,得到含I-的溶液。加入硝酸银溶液沉淀I-,得到AgI沉淀,此为富集碘的过程。再向AgI固体中加入过量的铁和水,不断的搅拌,反应生成Ag单质固体和FeI2溶液,过滤,滤液为FeI2溶液,滤渣为Ag和未反应完的Fe。向滤液FeI2中通入Cl2,生成I2和FeCl3(或FeCl2);加入CCl4萃取,分液分离得到I2的CCl4溶液。
(1)图中A为坩埚;
(2)①滤渣中含有Fe和Ag,可以利用Fe和Ag的活泼性不同,用酸将二者分离。Fe与稀硫酸、盐酸反应,而Ag不反应,故可以用稀硫酸或盐酸分离Fe和Ag。具体操作为:将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤;
②Ag可以和稀硝酸反应生成AgNO3、NO和水,离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O;
(3)操作II为加入CCl4萃取,有机层为I2的CCl4溶液。CCl4的密度大于水,先将下层的有机溶液放入烧杯中,再将上层液体从上口倒出。具体操作为:打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中;
(4)可以利用KSCN检验溶液中是否含有Fe3+,具体操作为为:取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+。
【题型】综合题
【结束】
25
【题目】利用钛白工业的副产品FeSO4[杂质仅为少量[Fe2(SO4)3]可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

(1)用离子方程式表示“除杂”的原理:__。
(2) “沉淀”过程控制反应温度为40℃,温度不宜过高的原因是__。
(3)实验室测定副产品FeSO4杂质仅为少量[Fe2(SO4)3]+ Fe2(SO4)3含量的步骤如下:
步骤1:将适量副产品配成水溶液,向其中加入2molL-1BaCl2溶液使SO42-沉淀完全,过滤。
步骤2:将步骤1所得沉淀洗涤,烘干至恒重,称得其质量为11.65 g。
步骤3:用0.2000molL-1KMnO4溶液与步骤1所得滤液作用,恰好完全反应时消耗其体积为20.00 mL。
(该步骤中反应的方程式为:5Fe2+ + MnO4- + 8H+ = 5Fe3++Mn2++4H2O)
①步骤1中证明SO42-沉淀完全的操作为__。
②欲配制0.2000 molL-1 KMnO4 50 mL,若定容时俯视,则所配KMnO4溶液浓度会__。(填“偏大”、“偏小”、“不变”)
③该副产品中所含杂质Fe2(SO4)3的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )
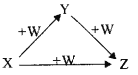
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com