
【题目】液氨和水类似,也能电离:NH3+NH3![]() NH4++NH2﹣,25℃时,其离子积K=1.0×10﹣30mol2L﹣2.现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
NH4++NH2﹣,25℃时,其离子积K=1.0×10﹣30mol2L﹣2.现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
A.c(Na+)=c(NH2﹣) B.c(NH4+)=1.0×10﹣29molL﹣1
C.c(NH2﹣)>c(NH4+) D.c(NH4+) c(NH2﹣)=1.0×10﹣30 mol2L﹣2
【答案】A
【解析】
试题分析:A.溶液中电荷守恒,所以c(Na+)+c(NH4+)=c(NH2-),故A错误; B.2.3g金属钠投入1.0L液氨中发生反应为:2Na+2NH3=2NaNH2+H2↑,促进液氨的电离,[NH4+][NH2-]=l.0×l0-30;反应生成NH2-物质的量为0.1mol,浓度为0.1mol/L,所以所得溶液中NH4+的浓度l.0×l0-29mol/L,故B正确; C.C(NH2-)=0.1mol/L,c(NH4+)=l.0×l0-29mol/L,所以c(NH2-)>c(NH4+),故C正确; D.离子积常数只与温度有关,温度不变,离子积常数不变,故D正确;故选A。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。
回答下列问题:
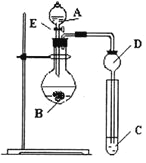
(1)图中D装置名称是 。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
试剂A为_________;试剂C为_________(填序号)。
(3)乙同学设计的实验所用到试剂A为________;试剂C为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水。
(1)写出反应①中氧化还原反应的离子方程式: ______________。
(2)向反应①后的溶液中加浓氨水的目的是: __________________。
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________;②______________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴滴入浓度为c mol·L-1的Na2S2O3标准溶液至反应终点,消耗Na2S2O3溶液V mL。
已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①滴定终点的现象为____________,产品中CaO2的质量分数为_________________
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________ (填“不受影响”“偏低”或“偏高”),原因是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明氢氟酸是弱酸的实验事实是
A.HF溶液与Zn反应放出H2
B.0.1mol/LNaF溶液的pH大于7[
C.HF溶液与Na2CO3反应生成CO2
D.0.1mol/LHF溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能(KJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
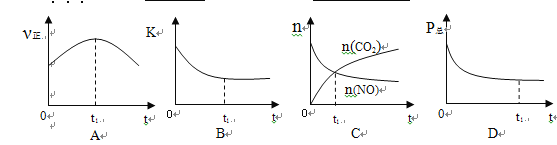
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是_________(填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
 (2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K=__,既能增大反应速率又能使平衡正向移动的措施是_。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式________________________。
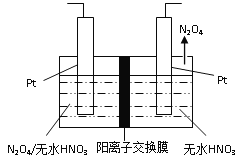
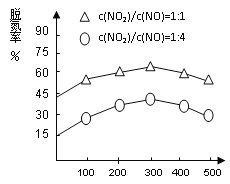
图1 图2
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响____________________,给出合理的解释:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
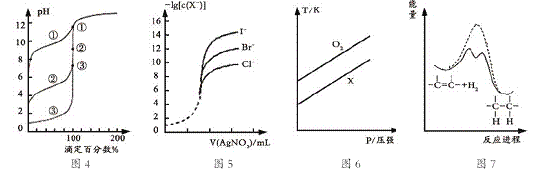
A. 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C. 在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D. 由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化硫可使酸性高锰酸钾溶液褪色,化学反应方程式为:
5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2。试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
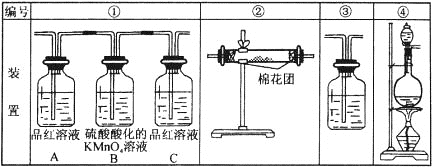
(1)这些装置的连接顺序是(按产物气流从左至右的方向,填写装置的编号):______→____→____→____。
(2)实验时可观察到装置①中A瓶的溶液褪色。A瓶溶液的作用是_________,B瓶溶液的作用是_______, C瓶溶液的作用是________________。
(3)装置②中所加的固体药品是____________,可验证的产物是____________。
(4)装置③中所盛溶液是_____________,可验证的产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子,若向其中加入Na2O2粉末,则充分反应后溶液中离子浓度保持不变的是(溶液体积变化忽略不计)
A. CO32- NO3- Na+ B. CO32- NO3- C. SO32- NO3- D. NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com