
【题目】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能(KJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
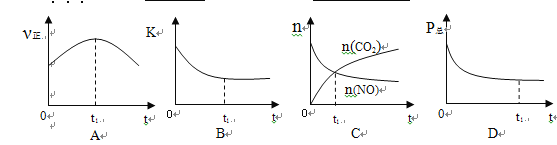
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是_________(填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
 (2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K=__,既能增大反应速率又能使平衡正向移动的措施是_。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式________________________。
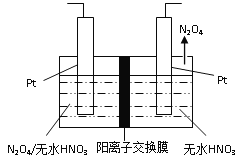
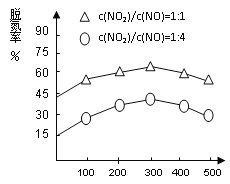
图1 图2
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响____________________,给出合理的解释:____________________________________。
【答案】 -538 A,B,C 500 加压等。 N2O4+2HNO3-2e-=2N2O5+2H+ 300℃之前,温度升高脱氮率逐渐增大 300℃之后,温度升高脱氮率逐渐减小
300℃之前,反应未平衡,反应向右进行,脱氮率增大 300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小
【解析】(1)①本题考查焓变与键能的关系,△H=反应物键能总和-生成物键能总和=[2×632+2×1072-(946+4×750)]kJ·mol-1=-538kJ·mol-1;②本题考查化学平衡状态的判断,A、因为是恒温恒容,因此正反应速率随着反应进行而减小,故说法错误;B、化学平衡常数只受温度的影响,温度不变,化学平衡常熟不变,因为是恒温状态,因此化学平衡状态不变,故说法错误;C、根据图像,t1时刻没有达到平衡,故说法错误;D、压强与物质的量成正比,反应前气体物质的量大于反应后气体物质的量,因此随着反应进行,压强减少,故说法正确;(2)本题考查化学平衡常数的计算以及影响化学反应速率和平衡移动因素,
2NO(g)+2CO(g)![]() N2(g) + 2CO2(g)
N2(g) + 2CO2(g)
起始:(mol·L-1) 1×10-2 3.6×10-2 0 0
变化: 9×10-3 9×10-2 4.5×10-3 9×10-3
平衡: 1×10-3 2.7×10-2 4.5×10-3 9×10-3,根据平衡常数定义,K=c2(CO2)×c(N2)/[c2(NO)×c2(CO)],代入数值,解得K=500,增大反应速率以及反应向正反应方向移动,采取措施是加压,增加NO或CO的浓度等;(3)本题考查电极反应式的书写,阳极是失电子,化合价升高,根据工作原理,阳极应是左端的Pt,N2O4-2e-→N2O5,加入无水HNO3,因此电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+;(4)根据图像得出:300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小。


科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性, r溶液是一种常见的强酸,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是
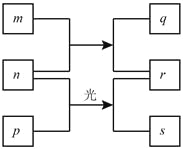
A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是

A.若b、c两点的平衡常数分别为K1、K2,则K1>K2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率可采取增加Br2(g)通入量的方法
D.b、c两点的HBr的体积分数b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨和水类似,也能电离:NH3+NH3![]() NH4++NH2﹣,25℃时,其离子积K=1.0×10﹣30mol2L﹣2.现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
NH4++NH2﹣,25℃时,其离子积K=1.0×10﹣30mol2L﹣2.现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
A.c(Na+)=c(NH2﹣) B.c(NH4+)=1.0×10﹣29molL﹣1
C.c(NH2﹣)>c(NH4+) D.c(NH4+) c(NH2﹣)=1.0×10﹣30 mol2L﹣2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯的说法中,不正确的是( )
A. 是无色气体,比空气略轻,难溶于水
B. 与溴水发生取代反应而使溴水褪色
C. 乙烯的产量标志着一个国家的石油化工水平
D. 可用点燃法鉴别乙烯和甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景。如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料。下列有关该镁燃料电池的叙述正确的是
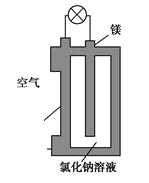
A. 该电池的总反应为2Mg+O2=2MgO
B. 反应生成O2-,该离子有正极移向负极
C. Cl-在阳极失去电子生成Cl2
D. 正极反应式为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
I.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序数为26的铁元素位于元素周期表的第_______周期。
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量消耗4.8g。则该段时间内用H2表达的平均反应速率为____________。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是___________。
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g)![]() Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Ⅲ. Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O![]() Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反应的平衡常效K1、K2、K3由大到小的顺序是_______。通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是__________(填字母)
a.加水稀释 b.加入少量NaCl固体 c.升温 d.加入少量Na2CO3固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com