
����Ŀ��������A��һ�ֻ�������ԭ�ϣ����Դ�ú��ʯ���еõ���OPA��һ����Ҫ���л������м��壬A��B��C��D��E��F��OPA��ת����ϵ������ʾ��

��֪��![]()
�ش��������⣺
��1��A�Ļ�ѧ������______��
��2��д������C���п��ܵĽṹ��ʽ________________________________��
��3��OPA���м���E�ɺϳ�һ�־�����߷��ӻ�����F��д��E��F�ķ�Ӧ�Ļ�ѧ����ʽ______________________________________���÷�Ӧ�ķ�Ӧ������____________��
��4�������ּ���������Һ�����Ʒ�����ȡlmL2%��__________��Һ�ڽྻ���Թ��У�Ȼ�������ε���2%�� ___________����____________________________Ϊֹ��
д��OPA�����������Һ��Ӧ�����ӷ���ʽ_______________________________________��
��5�����㻯����G��E��ͬ���칹�壬G�����к���ȩ�����������ѻ����ֺ��������ţ�д��G����һ�ֿ��ܵĽṹ��ʽ__________________��
��6��D(�ڱ������������)��һ�����ܼ���д����A�����ʵ��л��P���Լ�Ϊԭ�ϣ���������Ӧ�ϳ�D��·��_____________________________________��
���𰸡� �ڶ��ױ� 
 ���۷�Ӧ ������ ��ˮ ��������ij���ǡ���ܽ�
���۷�Ӧ ������ ��ˮ ��������ij���ǡ���ܽ� 


�����������⿼���л�����ƶϣ���1��A��B��Ӧ�����ǹ��������£���Br2����ȡ����Ӧ������B�Ľṹ��ʽ���Ƴ�A�Ľṹ��ʽΪ�� ������Ϊ�ڶ��ױ�����2��A��C��FeBr3����������Br2����ȡ����Ӧ����ԭ��ȡ�������ϵ���ԭ�ӣ���ṹ��ʽΪ
������Ϊ�ڶ��ױ�����2��A��C��FeBr3����������Br2����ȡ����Ӧ����ԭ��ȡ�������ϵ���ԭ�ӣ���ṹ��ʽΪ ����3��������Ϣ���Լ�E�ķ���ʽC8H8O3���Ƴ�E�Ľṹ��ʽΪ��
����3��������Ϣ���Լ�E�ķ���ʽC8H8O3���Ƴ�E�Ľṹ��ʽΪ�� ��FΪ������߷��ӻ����Eͨ�����۷�Ӧ����F����Ӧ����ʽΪ��
��FΪ������߷��ӻ����Eͨ�����۷�Ӧ����F����Ӧ����ʽΪ�� ����4��������Һ��������ȡ1mL2%����������Һ�ڽྻ���Թ��У�Ȼ�������ε���2%�İ�ˮ������ɫ����ǡ���ܽ�Ϊֹ����Ӧ����ʽΪ��
����4��������Һ��������ȡ1mL2%����������Һ�ڽྻ���Թ��У�Ȼ�������ε���2%�İ�ˮ������ɫ����ǡ���ܽ�Ϊֹ����Ӧ����ʽΪ�� ����5����Ϊ����ȩ�������������ݷ���ʽ���˶�����ͬ���칹��Ӧ�Ǽ���ij������ʽ������Ҫ���ͬ���칹����
����5����Ϊ����ȩ�������������ݷ���ʽ���˶�����ͬ���칹��Ӧ�Ǽ���ij������ʽ������Ҫ���ͬ���칹���� ����6������Ŀ������ԭ�����ڱ���������Ҵ�����������Ӧ���ڶ��ױ�ͨ�����������ڱ������ᣬ�ϳ�·����
����6������Ŀ������ԭ�����ڱ���������Ҵ�����������Ӧ���ڶ��ױ�ͨ�����������ڱ������ᣬ�ϳ�·���� ��
��


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȿ�������������������ϩ���ֿ���������ȥ�����е���ϩ�Եõ���������ķ����ǣ�������
A. ͨ��������NaOH��Һ B. ͨ����������ˮ
C. ��Ni��������������ͨ��H2 D. ͨ������������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������N2H4���ֳ��£�����N2O4����������ƽ�����
��1���������������Ǵ�ѧʥ���Ǹ��G�� N��SChrauzer�����õ���ˮ�����ڴ�ý�Ϲ������ºϳɸ�����̬��������ɹ�����д���÷�Ӧ���Ȼ�ѧ����ʽ��_________��
��ѧ�� | ����/KJ��mol-1 |
N-H | 391 |
H-O | 463 |
O=O | 496 |
N��N | 946 |
N-N | 159 |
��2��ˮ��������N2H4��H2O�����к�ǿ�Ļ�ԭ�ԡ���ҵ����ˮ��������ԭ����ȡ�⻯�ƹ��塣������ǽ����ʵ����NaOH��Һ�н��з�Ӧ���ټ���ˮ��������Ҫ�����������з�Ӧ����֪��N2H4��H2O��100�� ���Ϸֽ⡣
�� ���Ʊ�NaI�Ĺ����У����ܻ��е�������_______������������Ҫ�ʵ�����NaOH��Ŀ��___________��
�� Ϊ�˷�ֹˮ���������·ֽ⣬��Ӧ�¶ȿ�����60-70�棬�¶�Ҳ���ܹ��ͣ���ԭ����______��
�� ��ҵ��Ҳ���������ƻ���м��ԭ�������Ʊ��⻯�ƣ���ˮ��������ԭ���ƵõIJ�Ʒ���ȸ��ߣ���ԭ����___________
��3��325K����ʼѹǿΪ100kPaʱ���ں��ݵ��ܱ������г���4.6 g NO2,������Ӧ��
2NO2(g) ![]() N2O4(g)���ﵽƽ��������ڻ�������ƽ����Է�������Ϊ57.5��
N2O4(g)���ﵽƽ��������ڻ�������ƽ����Է�������Ϊ57.5��
�� NO2��N2O4��������������Ũ�ȵĹ�ϵ��ͼ��ʾ��ͼ�н���A��ʾ�÷�Ӧ������״̬Ϊ________��

A��ƽ��״̬ B��������Ӧ�����ƶ� C�����淴Ӧ�����ƶ� D�����ж�
�� ƽ��ʱNO2��ת����Ϊ_______���������µ�Kp=_______��Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йس����ʣ�������Ϊ���ʣ��IJ����У��϶�������ǣ� ��
A.���飨��ϩ����ͨ��ʢ��������ˮ��ϴ��ƿ
B.�����飨�Ҵ�������μ�ˮ����Һ����ˮ��
C.�Ҵ���ˮ��������
D.�屽���壩����ϡ����������Һ�����ϴ�Ӻ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽��FeSO4��Cu(NO3)2�Ļ�����и���ֵĺ�����������������̣�
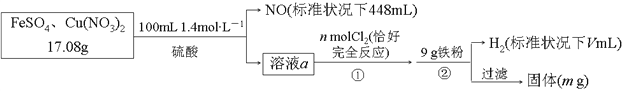
���������в���ȷ����
A. n=0.02 B. V=2240 C. m=3.2 D. ԭ�������FeSO4����������ԼΪ89%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ɫ��ˮ��Һ�У��ܴ��������һ��������
A. H+��Mg2+��Cl����SO42�� B. K+��Mg2+��CO32����Cl��
C. Na+��Ba2+��HCO3����OH�� D. K+��Cu2+��SO42����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Ԫ�����ڱ���һ���֣�
�� | X |
Y | Z |
��1
���ݱ�� | ����NaOH��Һ�����/mL | ��Һ��pH | |
HX | HZ | ||
�� | 0 | 3 | 1 |
�� | 20.00 | a | 7 |
��2
25��ʱ����Ũ��Ϊ0.1000mol/L������������Һ�ֱ�ζ�20.00 mLŨ�Ⱦ�Ϊ0.1000mol/ L��������HX��HZ��������Һ����仯����ʵ���������2�������ж���ȷ����
A. ������a<7
B. 25��ʱ��HX�ĵ��볣��Ka=1��10-6
C. Y��Z��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�߷ֽ��¶ȸ�
D. 0.1000mol/L Na2Y��ˮ��Һ����c(Y2-)+c(HY-)��c(H2Y)=0.1000mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������Һ�е����й�ϵʽ����ȷ����
A. ��֪A-+H2B(����)==HA+HB-������H+��������HB-<A-<B2-
B. ��0.1mol��L-1�İ�ˮ�еμ�0.1 mol��L-1���ᣬǡ����ȫ�к�ʱ�� c(NH4+)+c(NH3 H2O)=0.05 mol��L-1
C. ��c mol��L-1�Ĵ�����Һ��0.02 mol��L-1NaOH��Һ�������Ϻ���Һǡ�ó����ԣ��ú�c�Ĵ���ʽ��ʾCH3COOH�ĵ��볣��ka=![]()
D. ��0.2 mol��L-1������0.1 mol��L-1��KAlO2��Һ�������ϣ���Һ������Ũ���ɴ�С��˳��c(Cl-)> c(K+)> c(Al3+)> c(H+)> c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������������Ƭ�ϵ�ʳ��ˮ������һ��ʱ�����Ƭ���������������Ƭ��ʴ�����з������ܻ�ѧ����ʽ��2Fe��2H2O��O2===2Fe(OH)2��Fe(OH)2��һ������������ΪFe(OH)3������һ����������ˮ������������ԭ����ͼ������˵����ȷ����(����)

A. ��Ƭ������ԭ��Ӧ������ʴ
B. ��Ƭ��ʴ����������Ӧ����������������
C. ��Ƭ��ʴ�и��������ĵ缫��Ӧ��2H2O��O2��4e��===4OH��
D. ��Ƭ�������̼��ʳ��ˮ�γ�����Сԭ����������˵绯ѧ��ʴ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com