
【题目】硫酸工业尾气中的SOj是常见的大气污染物,可通过以下几种方式变废为宝:
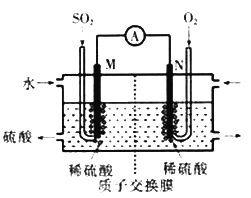
(1)电化学处理法:硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料)写出N极发生的电极反应式________________________;溶液中的阳离子向______极(M或N)移动,标准状况下,当有22.4LSO2参加反应时,溶液中有________mol阳离子向该极移动。
(2)钠碱循环法:用Na2SO3溶液作为吸收液来吸收SO2,尾气通入1mol/L的Na2SO3溶液中,①当溶液的PH约为6时,Na2SO3溶液吸收SO2的能力显著下降,此时溶液中c (SO32-)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为_______________。
②当溶液的PH降至约为6时,需送至电解槽再生,再生示意图如下:
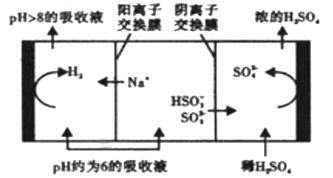
HSO3-在阳极放电的电极反应式是______________________________。
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:___________。
【答案】 O2+4H++4e- ==2H2O N 2 c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) HSO3-+H2O-2e- ==SO42-+3H+ 或SO32-+H2O-2e- ==SO42-+2H+ H+在阴极得电子生成H2,溶液中C(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,使吸收液再生
【解析】(1)N电极通入氧气,是原电池的正极,电解质溶液显酸性,则N极发生的电极反应式为O2+4H++4e-==2H2O;溶液中的阳离子向正极,即向N极(M或N)移动;标准状况下,当有22.4LSO2即1mol二氧化硫参加反应时转移2mol电子,根据电荷守恒可知溶液中有2mol阳离子向该极移动。(2)①当溶液的pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,说明大部分转化为亚硫酸氢钠,此时溶液中c (SO32-)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)。②HSO3-在阳极发生失去电子的氧化反应,则放电的电极反应式是HSO3-+H2O-2e-==SO42-+3H+。由于H+在阴极得电子生成H2,溶液中c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,从而使吸收液再生。


科目:高中化学 来源: 题型:
【题目】实验室里要配制400mL0.2mol/L的硫酸钠溶液。实验步骤如下:
A.在天平上称出_______g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。
B.把得到的溶液冷却后小心地沿着__________注入_______________ 中。
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用________小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切。
E.将瓶塞塞紧,充分摇匀。
F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(1) 请填写上述空白处。
(2) 下列情况会使所配溶液浓度偏低的是___________(填序号)。

a.某同学定容时观察液面的情况如图所示
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线
d.B操作时将少量液体洒到外面
e.容量瓶用前内壁沾有水珠
(3) 如果实验室用18mol/L的浓硫酸配制3. 6mol·L-1的稀硫酸250mL。计算所需浓硫酸的体积为___________mL,在实验时应用_________量取浓硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是

A. 原溶液中NaOH的物质的量为0.75mol
B. 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C. 通入CO2后所得的溶液中含有2.5×10-3mol NaHCO3
D. 原溶液通入CO2标准状况下为112mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电解NaCl水溶液,下列叙述正确的是 ( )
A. 电解时在阳极得到氯气,在阴极得到金属钠
B. 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C. 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D. 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法中正确的是
A. 17g甲基(—14CH3)所含中子数为9NA
B.常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
C.0.1molC5H12分子中含有的C-C键数为0.5NA
D.标准状况下,2.24L辛烷在氧气中完全燃烧生成CO2分子数为0.8 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐。易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠进行多角度探究:
I.亚硝酸钠的制备

(1)实验中用恒压滴液漏斗,相比于普通分液漏斗,其显著优点是___________。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的化学反应方程式__________________。
Ⅱ.探究亚硝酸钠与硫酸反应气体产物的成分
已知:①NO+NO2+2OH-=2NO2-+2H2O ②气体液化的温度:NO2 为21℃、NO为 -152℃

(3)反应前应打开弹簧夹,先通入一段时间的氮气,目的是___________________。
(4)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接)为A、C、_______、_______、_______。
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体。
①确认A中产生气体含有NO,依据的现象是____________________________。
②装置E的作用是__________________________________________________。
(6)如果没有装置C,对实验结论造成的影响是________________________。
(7)通过上述实验探究过程,可得出装置A中反应的离子方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国劳伦斯·利弗莫尔国家实验室2006年成功合成了118号超重元素,并观察到其存在了不到1毫秒时间。该元素符号为:Uuo,质量数为293,以下叙述不正确的是
A. 该元素原子核外含有118个电子,核内有175个中子
B. 该元素属于第七周期
C. 该元素一定是一种金属元素
D. 该元素位于零族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡.
(1)醋酸是常见的弱酸.
① 醋酸在水溶液中的电离方程式为________________________________________________;
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号) 。
A.滴加少量浓盐酸 B.微热溶液 C.加水稀释 D.加入少量醋酸钠晶体
(2)用0.1 molL-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 molL-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

① 滴定醋酸的曲线是______________(填“I”或“Ⅱ”);
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____________________;
③ V1和V2的关系:V1 _____ V2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加32 g。据此回答问题: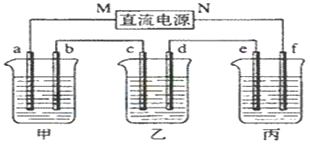
(1) 电源的N端为_________极;
(2) 电极b上发生的电极反应为____________________________________________;
(3) 电极f上生成的气体在标准状况下的体积_________________________________;
(4) 电解开始时,在甲烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是______________;
(5) 电解前后溶液的pH变化情况,(填增大、减小或不变)甲溶液___________;乙溶液_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com