
【题目】美国劳伦斯·利弗莫尔国家实验室2006年成功合成了118号超重元素,并观察到其存在了不到1毫秒时间。该元素符号为:Uuo,质量数为293,以下叙述不正确的是
A. 该元素原子核外含有118个电子,核内有175个中子
B. 该元素属于第七周期
C. 该元素一定是一种金属元素
D. 该元素位于零族
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】CO是生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)几种共价键的键能如下表所示:
化学键 | O=O | H—H | O—H |
键能(kJ/mol) | 496 | 436 | 462 |
已知:O2(g)+2C(s)=2CO(g) △H= -220kJ·mol-1,则H2O(g)+C(s) = CO(g)+H2(g) △H=___ kJ·mol-1。
(2)200℃时,将物质的量均为1mol的CO2和C(s)加入2L的密闭容器中,在一定条件下发生反应:CO2(g)+C(s) ![]() 2CO(g) △H,平衡时CO的体积分数为40%。
2CO(g) △H,平衡时CO的体积分数为40%。
①下列事实能够说明该反应达到平衡状态的是____________。
a.混合气体的平均相对分子质量不变
b.该反应的△H不变
c. CO2和CO的生成速率相等
d.混合气体的密度不变
②达到平衡时CO2的转化率为__________________。
③若在300°C时,将物质的量均为lmol的CO2和C(s)加入1L的密闭容器中,平衡时CO的体积分数为50%,则该反应的△H_____0 (填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)溶质的质量分数为b%的KOH溶液,经加热蒸发去ag水后,质量分数变成 2b%,体积为VmL,则此时溶液的物质的量浓度为___________。(答案必须为最简形式)
(2)将6mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成3mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为__________mL。
(3)密度为1.19g/cm3的盐酸,质量分数为25%。该盐酸用等体积的水稀释后,所得溶液中溶质的质量分数_______(填“大于”、“小于”或“等于”)12.5%。
(4)已知20℃时,饱和NaCl溶液的密度为ρg/cm3,物质的量浓度为c mol/L,则饱和NaCl溶液的溶解度为_________g。(答案必须为最简形式)
(5)相同质量的NO2和N2O4的质子数之比为_______,电子数之比为_______________。
(6)请用单线桥表示化学方程式CaH2+2H2O=Ca(OH)2+2H2↑电子转移的方向和数目___________。
(7)若将过量的NaOH溶液加入NH4HCO3溶液中,则反应的化学方程式__________________,若将NaOH溶液加入过量的NH4HCO3溶液中,则反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中的SOj是常见的大气污染物,可通过以下几种方式变废为宝:
(1)电化学处理法:硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料)写出N极发生的电极反应式________________________;溶液中的阳离子向______极(M或N)移动,标准状况下,当有22.4LSO2参加反应时,溶液中有________mol阳离子向该极移动。
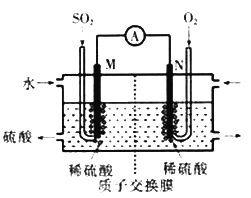
(2)钠碱循环法:用Na2SO3溶液作为吸收液来吸收SO2,尾气通入1mol/L的Na2SO3溶液中,①当溶液的PH约为6时,Na2SO3溶液吸收SO2的能力显著下降,此时溶液中c (SO32-)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为_______________。
②当溶液的PH降至约为6时,需送至电解槽再生,再生示意图如下:
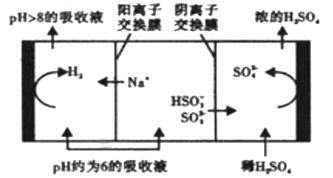
HSO3-在阳极放电的电极反应式是______________________________。
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是( )
A. “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
B. “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化
C. “爆竹声中除旧岁,春风送暖入屠苏”爆竹爆炸发生的是分解反应
D. “火树银花”中的焰火实质上是金属元素的焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入M (g)和N (g),发生反应M (g) +N (g) ![]() 2P (g) +Q (s),所得实验数据如下表:
2P (g) +Q (s),所得实验数据如下表:

下列说法正确的是
A. 实验①中,若5 min时测得n(N) = 0.050 mol,则0~5min时间内平均反应速率v(P) = 0.015 mo1/(L·min)
B. 实验②中达到平衡后,增大压强,M的转化率增大,平衡常数不变
C. 600℃时该反应的平衡常数K=3.0
D. 实验③中,达到平衡时,x<0.10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 元素的种类由最外层电子数决定
B. 化学键是存在于分子、原子和离子间的作用力
C. 原子的种类由原子核内质子数与中子数共同决定
D. 化学反应速率可以决定反应的限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如下转化:
![]() ,下列相关离子方程式或化学方程式错误的是
,下列相关离子方程式或化学方程式错误的是
A. ①可能为AlO2-+H++H2O=Al(OH)3↓
B. ①可能为Fe+2Fe3+=3Fe2+
C. ②可能为2NO+O2=2NO2
D. ②可能为Na2CO3+H2O+CO2=2NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 分子间作用力是把分子聚集在一起的作用力
B. 分子间作用力不属于化学键
C. 化学键包括离子键、共价键和氢键
D. 同种非金属元素原子间形成的化学键是非极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com