
【题目】将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)。下列计算结果正确的是
编号 | ① | ② | ③ | ④ |
硝酸体积/mL | 100 | 200 | 300 | 400 |
剩余金属/g | 18.0 | 9.6 | 0 | 0 |
NO体积/L | 2.24 | 4.48 | 6.72 | V |
A. ①中溶液存在Fe3+ B. 硝酸的浓度为4mol/L
C. ②中溶解了9.6gCu D. ④中V=6.72
【答案】B
【解析】
铁和铜均可以被硝酸氧化,由于还原性强弱关系为Fe>Cu>Fe2+,Fe、Cu、Fe2+将被硝酸依次氧化,过程发生的反应有:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O,据此分析。
A. 由表格可知,第①次实验中有固体金属剩余,因为还原性Fe>Cu>Fe2+,剩余的固体是铁和铜的混合物或只有铜,发生的反应有:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,可能部分Cu被氧化3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,所以①溶液中肯定没有Fe3+,A项错误;
B.第②次实验可以看作在第①实验后的混合物中继续加100mL稀硝酸,仍有9.6g固体金属剩余,说明HNO3耗尽,发生的反应只能是这两个反应中的1个或2个:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。产生NO体积4.48L-2.24L=2.24L,n(NO)=![]() =0.1mol。根据反应方程式得关系式4HNO3~NO,这100mL稀硝酸中HNO3的物质的量=4n(NO)=4×0.1mol=0.4mol,所以稀硝酸的浓度c(HNO3)=
=0.1mol。根据反应方程式得关系式4HNO3~NO,这100mL稀硝酸中HNO3的物质的量=4n(NO)=4×0.1mol=0.4mol,所以稀硝酸的浓度c(HNO3)=![]() =4mol/L,B项正确;
=4mol/L,B项正确;
C. 第②次实验可以看作在第①次实验后的混合物中继续加100mL稀硝酸,这100mL稀硝酸溶解金属的质量为18.0g-9.6g=8.4g,产生NO的物质的量n(NO)=![]() =0.1mol,发生的反应只能是这两个反应中的1个或2个:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。有关系式3Fe~8HNO3~2NO或3Cu~8HNO3~2NO,溶解金属的物质的量=
=0.1mol,发生的反应只能是这两个反应中的1个或2个:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。有关系式3Fe~8HNO3~2NO或3Cu~8HNO3~2NO,溶解金属的物质的量=![]() ×n(NO)=
×n(NO)= ![]() ×0.1mol=0.15mol,溶解的金属的平均摩尔质量=
×0.1mol=0.15mol,溶解的金属的平均摩尔质量=![]() =56g/mol(恰好是铁的摩尔质量),因此这100mL稀硝酸溶解的全是铁,所以实验②中没有铜溶解,C项错误;
=56g/mol(恰好是铁的摩尔质量),因此这100mL稀硝酸溶解的全是铁,所以实验②中没有铜溶解,C项错误;
D. 第③次实验可以看作在第②次实验后的混合物中继续加100mL稀硝酸,由表中数据可知,这100mL稀硝酸溶解金属9.6g,产生NO气体体积=6.72L-4.48L=2.24L(即0.1mol),据关系式HNO3~NO~得3e-,反应中转移电子0.3mol。如果全部是铜失电子,有关系式Cu~失2e-,则铜的质量=![]() ×64g/mol=9.6g,如果全部是铁失电子,有关系式Fe~2e-,则铁的质量=
×64g/mol=9.6g,如果全部是铁失电子,有关系式Fe~2e-,则铁的质量=![]() ×56g/mo=8.4g,所以③中9.6g固体全部是铜。结合上面C项分析可知第①、②次实验中参加反应的全部是铁,每份固体中铁的质量为8.4g×2=16.8g,n(Fe)=
×56g/mo=8.4g,所以③中9.6g固体全部是铜。结合上面C项分析可知第①、②次实验中参加反应的全部是铁,每份固体中铁的质量为8.4g×2=16.8g,n(Fe)=![]() =0.3mol,第③次实验所得溶液中含Fe(NO3)2的物质的量为0.3mol。继续加100mL稀硝酸则发生的反应是3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O,由B项可知100mL稀硝酸中含HNO3的物质的量为0.4mol,因此Fe(NO3)2和HNO3恰好反应完全,生成0.1molNO气体,即标准状况下2.24L,所以第④次实验产生NO气体体积V=6.72L+2.24L=8.96L,D项错误;答案选B。
=0.3mol,第③次实验所得溶液中含Fe(NO3)2的物质的量为0.3mol。继续加100mL稀硝酸则发生的反应是3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O,由B项可知100mL稀硝酸中含HNO3的物质的量为0.4mol,因此Fe(NO3)2和HNO3恰好反应完全,生成0.1molNO气体,即标准状况下2.24L,所以第④次实验产生NO气体体积V=6.72L+2.24L=8.96L,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是

A. b为正极,电极反应式为:O2+4H++4e-=2H2O
B. 电解质溶液中的H+移向a电极
C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
D. 呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:①O2和O3 ②H2、D2、T2 ③![]() 和
和![]() ④CH3CH2CH2CH3和
④CH3CH2CH2CH3和![]()
![]() 乙烷和丁烷
乙烷和丁烷
请用序号回答下列问题:
互为同系物的是______,互为同分异构体的是______,互为同位素的是______,互为同素异形体的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答:
(1)FeCl3水溶液呈酸性,原因是(用离子方程式表示):___________________,实验室配制FeCl3溶液的方法是__________________________。
(2)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂,写出使用时发生反应的离子方程式____________________________
(3)写出难溶电解质的溶度积表达式,Mg(OH)2:____________;在Mg(OH)2悬浊液中加入MgCl2固体,平衡________移动(填“正向”“逆向”或“不”),Ksp________(填“增大”“减小”或“不变”)。
(4)1 g炭与水蒸气反应生成CO和H2,需吸收a kJ热量,此反应的热化学方程式为______________________________________________。
(5)火箭发射时可用肼(N2H4)为燃料,以二氧化氮做氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g),ΔH=+67.7 kJ·mol-1;N2H4(g)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1,则N2H4和NO2反应的热化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用托盘天平称量食盐时,他将食盐放在右盘,砝码放在左盘,称得食盐的质量为15.5 g(1g以下使用游码)。该学生所称量的食盐的实际质量是( )
A.15.5 gB.15.0 gC.16.0 gD.14.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.金属只有正价,非金属只有负价
B.氟无正价,氧无最高正价
C.主族元素的最高正价等于其原子最外层电子数
D.同周期元素的最外层电子数越多,原子半径越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g) ![]() 2C(g),下列说 法中,能说明这一反应已经达到化学平衡状态的是
2C(g),下列说 法中,能说明这一反应已经达到化学平衡状态的是
A. 生成C的速率是生成A的速率的两倍
B. A、B、C的浓度相等
C. 单位时间生成 n mol A,同时生成 3n mol B
D. A、B、C的分子数之比为 1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
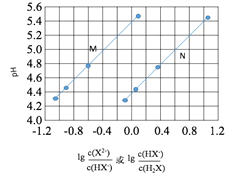
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com