
����Ŀ����Ҫ������
(1)FeCl3ˮ��Һ�����ԣ�ԭ����(�����ӷ���ʽ��ʾ)��___________________��ʵ��������FeCl3��Һ�ķ�����__________________________��
(2)��ĭ������װ��Al2(SO4)3��Һ��NaHCO3��Һ�����ݼ���д��ʹ��ʱ������Ӧ�����ӷ���ʽ____________________________
(3)д�����ܵ���ʵ��ܶȻ�����ʽ��Mg(OH)2��____________����Mg(OH)2����Һ�м���MgCl2���壬ƽ��________�ƶ�(�����������)��Ksp________(�������С�����䡱)��
(4)1 g̿��ˮ������Ӧ����CO��H2��������a kJ�������˷�Ӧ���Ȼ�ѧ����ʽΪ______________________________________________��
(5)�������ʱ������(N2H4)Ϊȼ�ϣ��Զ������������������������Ӧ���ɵ�����ˮ��������֪��N2(g)��2O2(g)===2NO2(g)����H����67.7 kJ��mol��1��N2H4(g)��O2(g)===N2(g)��2H2O(g)����H����534 kJ��mol��1����N2H4��NO2��Ӧ���Ȼ�ѧ����ʽ___________��
���𰸡�Fe3����3H2O![]() Fe(OH)3��3H��������������ˮ��Al3����3HCO
Fe(OH)3��3H��������������ˮ��Al3����3HCO![]() ===Al(OH)3����3CO2��Ksp��[Mg2��][OH��]2����C(s)��H2O(g)===CO(g)��H2(g)��H����12a kJ��mol��12N2H4(g)��2NO2(g)===3N2(g)��4H2O(g)����H����1 135.7 kJ��mol��1
===Al(OH)3����3CO2��Ksp��[Mg2��][OH��]2����C(s)��H2O(g)===CO(g)��H2(g)��H����12a kJ��mol��12N2H4(g)��2NO2(g)===3N2(g)��4H2O(g)����H����1 135.7 kJ��mol��1
��������
��1��Fe3����ˮ�ⷴӦ����ʽΪFe3����3H2O![]() Fe(OH)3��3H����Ϊ��������ʱ����ˮ��������ǣ�Ӧ����������������ˮ�⣬�ʴ�Ϊ��Fe3����3H2O
Fe(OH)3��3H����Ϊ��������ʱ����ˮ��������ǣ�Ӧ����������������ˮ�⣬�ʴ�Ϊ��Fe3����3H2O![]() Fe(OH)3��3H����������������ˮ������2����ĭ����Ϊԭ��ΪAl3����3HCO
Fe(OH)3��3H����������������ˮ������2����ĭ����Ϊԭ��ΪAl3����3HCO![]() ===Al(OH)3����3CO2������3��Mg(OH)2�ܶȻ�����ʽΪKsp��[Mg2��][OH��]2����Mg(OH)2����Һ�м���MgCl2����ʱ��������Mg2��Ũ�ȣ��ܽ�ƽ�������ƶ��������ܶȻ��Dz���ģ��ʴ�Ϊ��Ksp��[Mg2��][OH��]2����������������4��1 g̿��ˮ������Ӧ����CO��H2��������a kJ��������1mol̿��Ӧ����12akJ�����������Ȼ�ѧ��Ӧ����ʽΪC(s)��H2O(g)===CO(g)��H2(g)��H����12a kJ��mol��1����5���ɸ�˹���ɿɵ�N2H4��NO2��Ӧ���Ȼ�ѧ����ʽΪ��2N2H4(g)��2NO2(g)===3N2(g)��4H2O(g)����H����1 135.7 kJ��mol��1��
===Al(OH)3����3CO2������3��Mg(OH)2�ܶȻ�����ʽΪKsp��[Mg2��][OH��]2����Mg(OH)2����Һ�м���MgCl2����ʱ��������Mg2��Ũ�ȣ��ܽ�ƽ�������ƶ��������ܶȻ��Dz���ģ��ʴ�Ϊ��Ksp��[Mg2��][OH��]2����������������4��1 g̿��ˮ������Ӧ����CO��H2��������a kJ��������1mol̿��Ӧ����12akJ�����������Ȼ�ѧ��Ӧ����ʽΪC(s)��H2O(g)===CO(g)��H2(g)��H����12a kJ��mol��1����5���ɸ�˹���ɿɵ�N2H4��NO2��Ӧ���Ȼ�ѧ����ʽΪ��2N2H4(g)��2NO2(g)===3N2(g)��4H2O(g)����H����1 135.7 kJ��mol��1��


 ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ա����ж���ҽԺ�г������ᱵ���ֱ�����Ϊ�ڷ���Ӱ����ҽԺ���ȱ������ж�����ʱ���������⣬����Ҫ���ж���θ�й�����������Һ����֪��Ksp(BaCO3)��5.1��10��9 mol2��L��2��Ksp(BaSO4)��1.1��10��10 mol2��L��2�������ƶ���ȷ����(����)
A. ����̼�ᱵ��Ϊ�ڷ���Ӱ��������ΪKsp(BaCO3)>Ksp(BaSO4)
B. ���ȱ������ж�����ʱ����û�������ƣ�������̼������Һ����
C. ������[Ba2��]��1.0��10��5 mol��L��1����Һʱ�������������ж�
D. ������0.36 mol��L��1��Na2SO4��Һ���������ж�����ϴθ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�dz��������л���ı���ģ��ʾ��ͼ������˵������ȷ����(����)
A. �ײ���ʹ���Ը��������Һ����ˮ����ɫ
B. �ҿ�ʹ���Ը��������Һ����ˮ����ɫ,�ҷ�Ӧ����Ҳ��ͬ.
C. ������ʹ���Ը��������Һ����ˮ��Ӧ����ɫ
D. ����ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(K2S2O8) �ڿ����빤ҵ������Ҫ��;��
��1��H2S2O8�Ľṹʽ��ͼ������SԪ�صĻ��ϼ�Ϊ__________����Ag+���£�S2O82-��ʹ��Mn2+����Һ����Ϻ�ɫ������������___________�������ӷ��ţ���

��2��ij������ʪ��K2S2O8���������Ͱ����������ۺϴ�����¯�������������������Ч�ʣ�����Һ��������������ֲ���̻��ķ��ϡ�
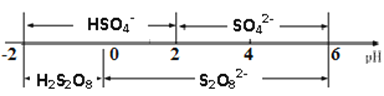
����������У���������Һ��pH=6ʱ��n(SO32-)��n(HSO3-)=________��
[��֪��25��ʱ��Ka1(H2SO3)=1.5��10-2��K a2(H2SO3)=1.0��10-7]
���������������η���������Ӧ����1����K2S2O8��NO������HNO2����2����K2S2O8��������HNO2����2����Ӧ�Ļ�ѧ����ʽΪ______________________________________��
��3����������ؿ�ͨ��������ת�����ᴿ�������Ƶã����װ��ʾ��ͼ��ͼ��ʾ��
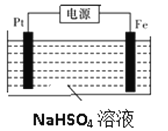
�ٵ��ʱ�����缫���ӵ�Դ��_________________����
�ڳ����£����Һ�к���������Ҫ������ʽ��pH�Ĺ�ϵ����ͼ��ʾ���������ŵ��������Ҫ��HSO4-���������������Һ��pH��ΧΪ_________�������ĵ缫��ӦʽΪ________________________��
��������Ʒ�м�������أ�ʹ��ת��Ϊ��������شֲ�Ʒ���ᴿ�ֲ�Ʒ�ķ���____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. Ǧ�����ڷŵ�����У�����������С��������������
B. SO3��Ba(NO3)2��Һ�ɵõ�BaSO4��SO2��Ba(NO3)2��Һ�ɵõ�BaSO3
C. ����ˮ������Al(OH)���壬��������ˮ��
D. �����£�SiO2(s)+3C(s)=SiC(s)+2CO(g)�����Է����У���÷�Ӧ����H<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO(g)+2H2(g) ![]() CH3OH(g)��һ�������£���0.5molCO��0.5molH2�����Ϊ2L���ܱ������з���������Ӧ��������ʾ��ͼ�������� ( )
CH3OH(g)��һ�������£���0.5molCO��0.5molH2�����Ϊ2L���ܱ������з���������Ӧ��������ʾ��ͼ�������� ( )
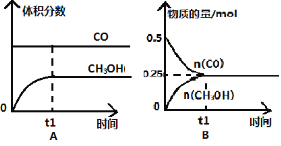
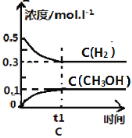

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ۺ�ͭ�۵ľ��Ȼ����ƽ���ֳ��ĵȷݣ��ֱ����ͬŨ�ȵ�ϡ���ᣬ��ַ�Ӧ���ڱ�״��������NO�������ʣ��������������±���������Ļ�ԭ����ֻ��NO�������м�������ȷ����
��� | �� | �� | �� | �� |
�������/mL | 100 | 200 | 300 | 400 |
ʣ�����/g | 18.0 | 9.6 | 0 | 0 |
NO���/L | 2.24 | 4.48 | 6.72 | V |
A. ������Һ����Fe3+ B. �����Ũ��Ϊ4mol/L
C. �����ܽ���9.6gCu D. ����V=6.72
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���Ӧ3Fe��s��+4H2O��g��![]() Fe3O4��s��+4H2��g������һ�ܱ������н��д�ƽ����Իش�
Fe3O4��s��+4H2��g������һ�ܱ������н��д�ƽ����Իش�
��1������Fe�����ʵ�����������Ӧ����___________����A����� B������ C������ǰ4������ĸ���ţ���
��2���������������Сһ�룬������Ӧ����___________ ���淴Ӧ����___________��
��3��������������䣬����Ar�����淴Ӧ����___________
��4������ѹǿ���䣬����Ar��������Ӧ���� ___________��
��5������ѹǿ���䣬����Ar���÷�Ӧ��___________ �����ƶ����������ơ����ƻ��ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ٣����ڱ��е�λ�ã��ش��������⣺
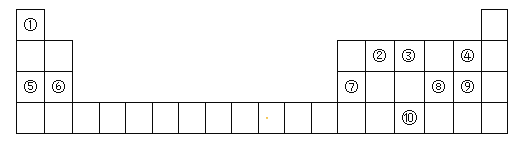
(1)Ԫ�آ������ڱ��е�λ����_____���ߵ�ԭ�ӽṹʾ��ͼΪ_____��
(2)�ܡ��ݡ��ļ����Ӱ뾶�ɴ�С��˳��Ϊ______�������ӷ��ź���������ʾ����
(3)�ܢ�����̬�⻯���У����ȶ�����______(�û�ѧʽ��ʾ��������������Ӧˮ�����У�������ǿ����_____(�û�ѧʽ��ʾ����
(4)�ݵ�����������Ӧ��ˮ������ߵ�����������Ӧ��ˮ�������Ӧ�����ӷ���ʽ___��
(5)�ɢ٢ۢ���ɵ����ӻ�����Ļ�ѧʽΪ____�����к��еĻ�ѧ��������______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com