
【题目】过二硫酸钾(K2S2O8) 在科研与工业上有重要用途。
(1)H2S2O8的结构式如图,其中S元素的化合价为__________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。

(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。
①脱硫过程中,当氨吸收液的pH=6时,n(SO32-)∶n(HSO3-)=________。
[巳知:25℃时,Ka1(H2SO3)=1.5×10-2,K a2(H2SO3)=1.0×10-7]
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,第2步反应的化学方程式为______________________________________;
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如图所示。
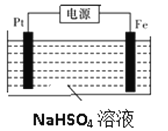
①电解时,铁电极连接电源的_________________极。
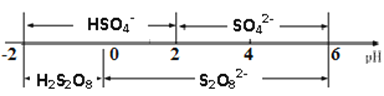
②常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为_________,阳极的电极反应式为________________________。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法____。
【答案】+6 MnO4- 1:10 HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4 负 0—2 2HSO4--2e-= S2O82-+2H+ 重结晶
【解析】
(1)过二硫酸结构简式为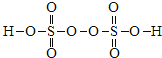 ,存在1个过氧键(-O-O-)、4个S=O键,4个S-O键,4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,根据化合价代数和等于0计算硫元素的化合价;过二硫酸中含有-1价氧原子,所以过二硫酸具有氧化性,S2O82-能使含Mn2+的溶液变成紫红色,说明有MnO4-生成;(2)①根据K a2(H2SO3)=
,存在1个过氧键(-O-O-)、4个S=O键,4个S-O键,4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,根据化合价代数和等于0计算硫元素的化合价;过二硫酸中含有-1价氧原子,所以过二硫酸具有氧化性,S2O82-能使含Mn2+的溶液变成紫红色,说明有MnO4-生成;(2)①根据K a2(H2SO3)=![]() 计算pH=6时,n(SO32-)∶n(HSO3-)的值;②亚硝酸被氧化为硝酸, S2O82-被还原为SO42-;(3)①NaHSO4溶液制取过二硫酸钾,氧元素失电子发生氧化反应,若铁作阳极,则铁失电子发生氧化反应;②根据阳极放电的离子是HSO4-,电解产物是Na2S2O8分析;根据溶解度不同提纯提纯粗产品;
计算pH=6时,n(SO32-)∶n(HSO3-)的值;②亚硝酸被氧化为硝酸, S2O82-被还原为SO42-;(3)①NaHSO4溶液制取过二硫酸钾,氧元素失电子发生氧化反应,若铁作阳极,则铁失电子发生氧化反应;②根据阳极放电的离子是HSO4-,电解产物是Na2S2O8分析;根据溶解度不同提纯提纯粗产品;
(1)过二硫酸结构简式为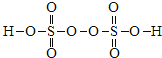 ,存在1个过氧键(-O-O-)、4个S=O键,4个S-O键,4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,根据化合价代数和等于0,硫元素的化合价为+6;过二硫酸中含有-1价氧原子,所以过二硫酸具有氧化性,S2O82-能使含Mn2+的溶液变成紫红色,说明有MnO4-生成,所以氧化产物是MnO4-;(2)①根据K a2(H2SO3)=
,存在1个过氧键(-O-O-)、4个S=O键,4个S-O键,4个S=O键中,4个O原子显-2价、过氧键(-O-O-)2个O原子显-1价,4个S-O键中4个O原子显-2价,根据化合价代数和等于0,硫元素的化合价为+6;过二硫酸中含有-1价氧原子,所以过二硫酸具有氧化性,S2O82-能使含Mn2+的溶液变成紫红色,说明有MnO4-生成,所以氧化产物是MnO4-;(2)①根据K a2(H2SO3)=![]() , pH=6时,
, pH=6时,![]()
![]() ,所以n(SO32-)∶n(HSO3-)=1:10;②亚硝酸被氧化为硝酸, S2O82-被还原为SO42-,反应方程式为HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4 ;(3)①NaHSO4溶液制取过二硫酸钾,氧元素失电子发生氧化反应,若铁作阳极,则铁失电子发生氧化反应,所以铁作阴极,连接电源负极;②根据图示,阳极放电的离子是HSO4-,电解产物是Na2S2O8,所以控制pH的范围是0—2;阳极的电极反应式为2HSO4--2e-= S2O82-+2H+;③提纯过二硫酸钾的方法是重结晶。
,所以n(SO32-)∶n(HSO3-)=1:10;②亚硝酸被氧化为硝酸, S2O82-被还原为SO42-,反应方程式为HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4 ;(3)①NaHSO4溶液制取过二硫酸钾,氧元素失电子发生氧化反应,若铁作阳极,则铁失电子发生氧化反应,所以铁作阴极,连接电源负极;②根据图示,阳极放电的离子是HSO4-,电解产物是Na2S2O8,所以控制pH的范围是0—2;阳极的电极反应式为2HSO4--2e-= S2O82-+2H+;③提纯过二硫酸钾的方法是重结晶。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
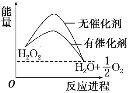
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH>0
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同主族非金属元素的简单阴离子的还原性越强,其元素非金属性越强
B. ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
C. 元素原子的最外层电子数等于元素的最高化合价
D. 全部由非金属元素组成的化合物中只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:①O2和O3 ②H2、D2、T2 ③![]() 和
和![]() ④CH3CH2CH2CH3和
④CH3CH2CH2CH3和![]()
![]() 乙烷和丁烷
乙烷和丁烷
请用序号回答下列问题:
互为同系物的是______,互为同分异构体的是______,互为同位素的是______,互为同素异形体的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
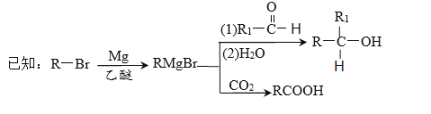
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图所示:
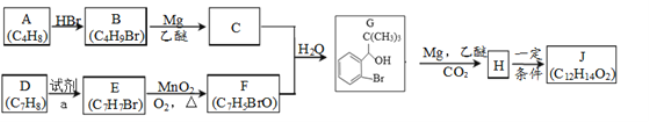
(1)A的名称是_______,E到F的反应类型是___________。
(2)试剂a是________,F中官能团名称是_______。
(3)M组成比F多1个CH2,M的分子式为C8H7BrO,M的同分异构体中:①能发生银镜反应;②含有苯环;③不含甲基。满足上述条件的M的同分异构体共有______种。
(4)J是一种酯,分子中除苯环外还含有一个五元环,J的结构简式为__________。H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为________。
(5)利用题中信息写出以乙醛和苯为原料,合成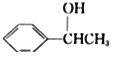 的路线流程图(其它试剂自选)。________。
的路线流程图(其它试剂自选)。________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答:
(1)FeCl3水溶液呈酸性,原因是(用离子方程式表示):___________________,实验室配制FeCl3溶液的方法是__________________________。
(2)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂,写出使用时发生反应的离子方程式____________________________
(3)写出难溶电解质的溶度积表达式,Mg(OH)2:____________;在Mg(OH)2悬浊液中加入MgCl2固体,平衡________移动(填“正向”“逆向”或“不”),Ksp________(填“增大”“减小”或“不变”)。
(4)1 g炭与水蒸气反应生成CO和H2,需吸收a kJ热量,此反应的热化学方程式为______________________________________________。
(5)火箭发射时可用肼(N2H4)为燃料,以二氧化氮做氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g),ΔH=+67.7 kJ·mol-1;N2H4(g)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1,则N2H4和NO2反应的热化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.金属只有正价,非金属只有负价
B.氟无正价,氧无最高正价
C.主族元素的最高正价等于其原子最外层电子数
D.同周期元素的最外层电子数越多,原子半径越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列叙述不正确的是
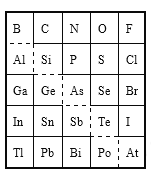
A. Sn的最高正价为+4
B. Br的最高价氧化物对应水化物的化学式为HBrO3
C. 酸性强弱:H3AsO4<H2SeO4
D. 原子半径比较:N<Si
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com