
【题目】设![]() 为阿伏加德罗常数的值,某二元酸(简写为
为阿伏加德罗常数的值,某二元酸(简写为![]() )溶液按下式电离:
)溶液按下式电离:![]() ,
,![]() ,关于常温下的下列溶液叙述错误的是( )
,关于常温下的下列溶液叙述错误的是( )
A.![]()
![]() 的
的![]() 溶液的
溶液的![]() 数目为
数目为![]()
B.在![]() 质量分数为46%的
质量分数为46%的![]() 水溶液中,含氧原子总数为
水溶液中,含氧原子总数为![]()
C.![]()
![]() 的
的![]() 溶液中
溶液中![]() 、
、![]() 、
、![]() 、
、![]() 总的粒子数为
总的粒子数为![]()
D.![]() 溶液中一定存在
溶液中一定存在![]()
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】已知镁能在O2、N2、CO2中燃烧生成相应的化合物。试回答:
(1)镁在空气中燃烧,除发生反应N2+3Mg![]() Mg3N2外,还能发生其他反应,写出反应的化学方程式:____________。
Mg3N2外,还能发生其他反应,写出反应的化学方程式:____________。
(2)镁条在氧气中燃烧时看到的现象是________。
(3)如果等质量的镁分别在足量的氧气、氮气、二氧化碳中燃烧,燃烧后固体的质量分别为m1、m2、m3,则它们的大小顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
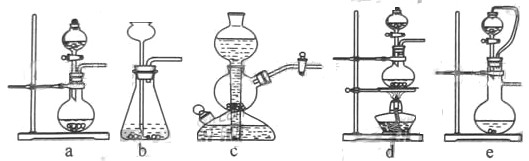
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置
是________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3,36L(标准状况)二氧化硫,至少需要称取亚硫酸钠______g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠______g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
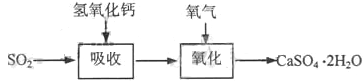
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
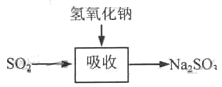
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是____________________。和碱法相比,石灰-石膏法的优点是________________,缺点是________________。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molI2和2molH2(g)置于某2L密闭容器中,在—定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线

(1)达平衡时,I2(g)的物质的量浓度为 _______。H2(g)的平衡转化率为___________。
在此温度下,该反应的平衡常数K__________(保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是______(填入下列条件的序号。下同),乙条件可能是________。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、 c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是_______________ (用含一个a、b、c的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原来从杨树中提取,现可用如下反应制备。下列有关叙述正确的是( )
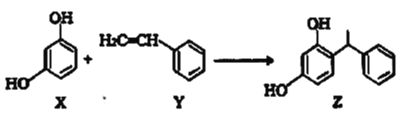
A.Z的分子式为![]()
B.X、Y分子中所有原子都可能处于同一平面
C.Y的苯环上二溴代物共有10种
D.X、Y和Z均能使溴水褪色且褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁代表4种纯净物。甲(g)+2乙(g) ![]() 丙(g)+丁(g) ΔH=-a kJ·mol1 (a>0),下列说法正确的是
丙(g)+丁(g) ΔH=-a kJ·mol1 (a>0),下列说法正确的是
A. 甲(g)的能量一定大于丙(g)的能量
B. 该反应不需要加热
C. 1 mol甲(g)与2 mol乙(g)的总能量高于1 mol丙(g)和1 mol丁(g)的总能量
D. 在一密闭容器中充入1 mol 甲(g)与2 mol 乙(g),在一定条件下反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL 0.1mol/LHX溶液中逐滴加入0.2molL1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论正确的是( )
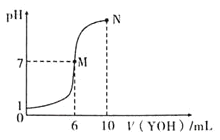
A.M点不存在:c(Y+)=c(X-)
B.N点水的电离程度大于M点水的电离程度
C.25℃时pH=4的YX溶液中电离出的c(H+)=1.0×![]()
D.N点对应溶液中粒子浓度关系存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)亚硝酸钠(NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+![]() Fe3+,转化1中,氧化剂是____,转化2中,维生素C表现____性。
Fe3+,转化1中,氧化剂是____,转化2中,维生素C表现____性。
(2)在①盐酸、②浓硝酸、③氨水、④稀硫酸、⑤氢氧化钠溶液五种物质中,可用于除去Al表面的铜镀层的是_____(填序号);实验室常用硫酸铝溶液和____(填序号)反应制取氢氧化铝,反应的离子反应方程式是_____。
(3)把一定量铜粉投入氯化铁、氯化铜的混合溶液中,完全反应后,所得溶液中Cu2+、Fe2+和Fe3+三种离子的浓度恰好相等。则原溶液中的Fe3+和Cu2+的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是

A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com