
【题目】室温下,向10mL 0.1mol/LHX溶液中逐滴加入0.2molL1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论正确的是( )
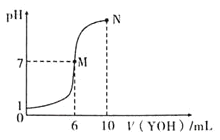
A.M点不存在:c(Y+)=c(X-)
B.N点水的电离程度大于M点水的电离程度
C.25℃时pH=4的YX溶液中电离出的c(H+)=1.0×![]()
D.N点对应溶液中粒子浓度关系存在:![]()
【答案】D
【解析】
开始时,0.1mol/LHX溶液的pH=1是强酸,![]() 与YOH恰好完全中和生成盐,需要YOH溶液5mL,如果YOH为强碱,则在横坐标为5mL时,pH=7,但是图象显示横坐标为6 mL时,pH=7,由此确定YOH为弱碱,据此分析。
与YOH恰好完全中和生成盐,需要YOH溶液5mL,如果YOH为强碱,则在横坐标为5mL时,pH=7,但是图象显示横坐标为6 mL时,pH=7,由此确定YOH为弱碱,据此分析。
A.由电荷守恒可知,c(Y+)+ c(H+)=c(X-)+c(OH-),M点溶液呈中性,c(H+)= c(OH-),M点存在:c(Y+)=c(X-),故A错误;
B.M点,水电离的H+浓度为![]() ,N点溶液呈碱性,YOH电离的OH-抑制了水电离,水电离的H+浓度小于
,N点溶液呈碱性,YOH电离的OH-抑制了水电离,水电离的H+浓度小于![]() ,所以M点水的电离程度大于N点水的电离程度,故B错误;
,所以M点水的电离程度大于N点水的电离程度,故B错误;
C.YX溶液中存在![]() ,促进水的电离,所以pH=4的YX溶液中水电离出的
,促进水的电离,所以pH=4的YX溶液中水电离出的![]() ,故C错误;
,故C错误;
D.N点为YOH与YX物质的量之比为1:1(YOH与YX等量混合),由物料守恒可以得:![]() ,由电荷守恒可得
,由电荷守恒可得![]() ,消去
,消去![]() 可得,
可得,![]() ,或者根据质子守恒也可以得到
,或者根据质子守恒也可以得到![]() ,故D正确;
,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
A. 容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B. v正(CO2)=v逆(H2O)
C. 容器内混合气体密度保持不变
D. 3molH-H键断裂同时生成3molH-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 对于平衡体系:mA(g)+ nB(g)![]() pC(g)+ qD(g),下列判断正确的是( )
pC(g)+ qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△ H<0
D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,某二元酸(简写为
为阿伏加德罗常数的值,某二元酸(简写为![]() )溶液按下式电离:
)溶液按下式电离:![]() ,
,![]() ,关于常温下的下列溶液叙述错误的是( )
,关于常温下的下列溶液叙述错误的是( )
A.![]()
![]() 的
的![]() 溶液的
溶液的![]() 数目为
数目为![]()
B.在![]() 质量分数为46%的
质量分数为46%的![]() 水溶液中,含氧原子总数为
水溶液中,含氧原子总数为![]()
C.![]()
![]() 的
的![]() 溶液中
溶液中![]() 、
、![]() 、
、![]() 、
、![]() 总的粒子数为
总的粒子数为![]()
D.![]() 溶液中一定存在
溶液中一定存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
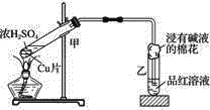
(1)判断铜与浓硫酸反应有二氧化硫生成所依据的现象是__________。
(2)甲装置中发生的主要反应的化学方程式是__________。
(3)装置乙中试管口放有一团浸有饱和碳酸钠溶液或氢氧化钠溶液的棉花,请写出二氧化硫与氢氧化钠溶液反应的离子方程式:_______。
(4)该反应中若有3.2 g 铜参加反应,则被还原硫酸的物质的量为______。
(5)含有0.2 mol 硫酸的浓硫酸,在加热时能否溶解6.4 g铜,结论和理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】P4S3是黄色或淡黄色结晶或粉末,无臭、无味、易燃、有毒,遇潮气发生分解,分子结构如图所示,已知其燃烧热ΔH=3 677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是
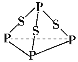
A.分子中磷元素显+3价
B.分子中每个原子最外层均达到8电子稳定结构
C.热化学方程式为P4S3(s)+8O2(g) ===P4O10(s)+3SO2(g) ΔH=3 677 kJ/mol
D.分子中存在极性键与非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 既是温室气体又是丰富的碳基资源。甲烷与二氧化碳重整反应是制合成气(
既是温室气体又是丰富的碳基资源。甲烷与二氧化碳重整反应是制合成气(![]() )的有效途径之一。合成气可用于二甲醚合成、羰基合成、费托合成等。因此,具有较好的市场前景。
)的有效途径之一。合成气可用于二甲醚合成、羰基合成、费托合成等。因此,具有较好的市场前景。
(1)已知在![]() 、298K条件下,各物质燃烧热数据如下表:
、298K条件下,各物质燃烧热数据如下表:
物质(g) |
|
|
|
|
燃烧热( | -890.0 | -283.0 | -285.0 | 0 |
则甲烷与二氧化碳重整反应制合成气的热化学方程式为:________________;
(2)在T℃时,向容积为2L的刚性容器中充入![]()
![]() 和
和![]()
![]() 。反应体系中
。反应体系中![]() 的物质的量随时间变化关系如下表:
的物质的量随时间变化关系如下表:
时间/min | 0 | 20 | 50 | 100 | |
| 0.5 | 0.48 | 0.25 | 0.25 | 0.25 |
①20min时,![]() ________
________![]() ;当反应进行到60min时,
;当反应进行到60min时,![]() ________20min时
________20min时![]() 的大小关系(填“<”、“=”或“>”);反应进行到60min时,下列能够提高平衡时合成气产率的措施有:_______________________。
的大小关系(填“<”、“=”或“>”);反应进行到60min时,下列能够提高平衡时合成气产率的措施有:_______________________。
A.将反应时间延长至150min B.移除一部分合成气
C.适当提高反应升高温度 D.改用高效催化剂
②反应进行到下列各图的p点时,能够说明该反应达到平衡状态的是:___________。
A. B.
B. C.
C.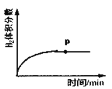 D.
D.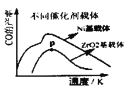
③已知:p(H2)、p(CO)、p(CH4)和p(CO2)为各组分的平衡分压(气体分压p=气体总压p总×体积分数),p总为平衡总压。若开始测得反应体系的压强为3.0Mpa,则合成气反应达到平衡状态时Kp=________。(结果保留一位小数)
(3)由于原料气的![]() 比较高,催化剂易结焦,特别是高温反应时积碳严重,影响了此过程大规模工业化的应用。某科研小组研究了Sr助剂对10%
比较高,催化剂易结焦,特别是高温反应时积碳严重,影响了此过程大规模工业化的应用。某科研小组研究了Sr助剂对10%![]() 催化剂性能的影响如表1所示,请判断催化剂上Sr助剂的最佳质量含量为________(横坐标表示Sr助剂的质量含量),判断的理由是________________(写出两点)
催化剂性能的影响如表1所示,请判断催化剂上Sr助剂的最佳质量含量为________(横坐标表示Sr助剂的质量含量),判断的理由是________________(写出两点)

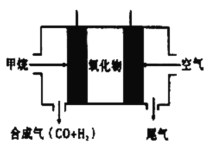
(4)如图所示,以![]() 为燃料气,高温电化学法制备合成气的发电系统中,
为燃料气,高温电化学法制备合成气的发电系统中,![]() 在电场作用下,通过氧化物电解质中氧空位迁移到负极,与
在电场作用下,通过氧化物电解质中氧空位迁移到负极,与![]() 发生氧化还原反应。试用电极反应方程式表示负极发生反应的总过程:___________________________________。
发生氧化还原反应。试用电极反应方程式表示负极发生反应的总过程:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,根据如图回答问题:
CO2↑+2SO2↑+2H2O,根据如图回答问题:
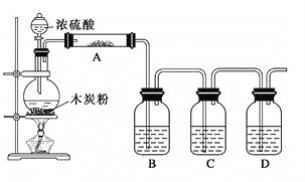
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气?__。
(2)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
①A中加入的试剂是___,作用是___;
②B中加入的试剂是___,作用是___;
③C中加入的试剂是___,作用是___;
④D中加入的试剂是___,作用是___。
(3)实验时,C中应观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
A. 1B. 2C. 3D. 4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com