
����Ŀ��ʵ���ҳ�������װ��������ͭ��Ũ���ᷴӦ��һϵ��ʵ�顣
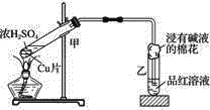
��1���ж�ͭ��Ũ���ᷴӦ�ж����������������ݵ�������__________��
��2����װ���з�������Ҫ��Ӧ�Ļ�ѧ����ʽ��__________��
��3��װ�������Թܿڷ���һ�Ž��б���̼������Һ������������Һ��������д����������������������Һ��Ӧ�����ӷ���ʽ��_______��
��4���÷�Ӧ������3.2 g ͭ�μӷ�Ӧ����ԭ��������ʵ���Ϊ______��
��5������0.2 mol �����Ũ���ᣬ�ڼ���ʱ�ܷ��ܽ�6.4 gͭ�����ۺ�������______��
���𰸡�����Ʒ����Һ��ɫ Cu��2H2SO4��Ũ��![]() CuSO4��SO2����2H2O 2OH����SO2=
CuSO4��SO2����2H2O 2OH����SO2=![]() ��H2O 0.05 mol ������ȫ�ܽ�6.4 gͭ��Ũ�����Ũ�Ȼ��淴Ӧ�Ľ��м�С����Ϊϡ�������ͭ��Ӧ
��H2O 0.05 mol ������ȫ�ܽ�6.4 gͭ��Ũ�����Ũ�Ȼ��淴Ӧ�Ľ��м�С����Ϊϡ�������ͭ��Ӧ
��������
��1�������������Ư���ԣ���ʹƽ����ɫ��
��2����װ����ͭ��Ũ�����ڼ��������·�����Ӧ���ɶ�����������ͭ��ˮ��
��3�������������ڴ�����Ⱦ�Ϊ��ֹ�����������Ҫ���Թܿڷ���һ�Ž��б���̼������Һ������������Һ�������������������������Һ��Ӧ�����������ơ�
��4�����ݷ�ӦCu��2H2SO4��Ũ��![]() CuSO4��SO2����2H2O���㣻
CuSO4��SO2����2H2O���㣻
��5��������ȫ��Ӧʱ��ͭ��������![]() ��64 g��mol��1��6.4 g����Ӧ��ʵ���ܽ�ͭ������С��6.4 g����Ϊ��ͭ��Ũ���ᷴӦ�Ľ��У�Ũ�����Ũ�ȼ�С����Ϊϡ�������ͭ��Ӧ��0.2 mol �������ȫ��Ӧ��
��64 g��mol��1��6.4 g����Ӧ��ʵ���ܽ�ͭ������С��6.4 g����Ϊ��ͭ��Ũ���ᷴӦ�Ľ��У�Ũ�����Ũ�ȼ�С����Ϊϡ�������ͭ��Ӧ��0.2 mol �������ȫ��Ӧ��
��1���ж�ͭ��Ũ���ᷴӦ�ж����������ɣ������ö����������Ư���ԣ���ʹƷ����Һ��ɫ������֤��������Ʒ����Һ��ɫ��ȥ��֤���ж������������
�ʴ�Ϊ������Ʒ����Һ��ɫ��
��2����װ����ͭ��Ũ�����ڼ��������·�����Ӧ���ɶ�����������ͭ��ˮ����ѧ��Ӧ����ʽ��Cu��2H2SO4��Ũ��![]() CuSO4��SO2����2H2O��
CuSO4��SO2����2H2O��
�ʴ�Ϊ��Cu��2H2SO4��Ũ��![]() CuSO4��SO2����2H2O��
CuSO4��SO2����2H2O��
��3�������������ڴ�����Ⱦ�Ϊ��ֹ�����������Ҫ���Թܿڷ���һ�Ž��б���̼������Һ������������Һ�������������������������Һ��Ӧ�����������ƣ����ӷ�Ӧ����ʽΪ��2OH����SO2=![]() ��H2O��
��H2O��
�ʴ�Ϊ��2OH����SO2=![]() ��H2O��
��H2O��
��4�����ݷ�ӦCu��2H2SO4��Ũ��![]() CuSO4��SO2����2H2O�ɵã�����ԭ����������ʵ���=���뷴Ӧ��ͭ�����ʵ�����3.2 g ͭ�����ʵ���=
CuSO4��SO2����2H2O�ɵã�����ԭ����������ʵ���=���뷴Ӧ��ͭ�����ʵ�����3.2 g ͭ�����ʵ���=![]() =0.05mol������ԭ����������ʵ���=0.05mol��
=0.05mol������ԭ����������ʵ���=0.05mol��
�ʴ�Ϊ��0.05mol��
��5�����ݷ�ӦCu��2H2SO4��Ũ��![]() CuSO4��SO2����2H2O�ɵã�������ȫ��Ӧʱ��ͭ��������0.2 mol��2��64 g��mol��1��6.4 g����Ϊ��ͭ��Ũ���ᷴӦ�Ľ��У�Ũ�����Ũ�ȼ�С����Ϊϡ�������ͭ��Ӧ����Ӧ��ʵ���ܽ�ͭ������С��6.4 g�� 0.2 mol �������ȫ��Ӧ��
CuSO4��SO2����2H2O�ɵã�������ȫ��Ӧʱ��ͭ��������0.2 mol��2��64 g��mol��1��6.4 g����Ϊ��ͭ��Ũ���ᷴӦ�Ľ��У�Ũ�����Ũ�ȼ�С����Ϊϡ�������ͭ��Ӧ����Ӧ��ʵ���ܽ�ͭ������С��6.4 g�� 0.2 mol �������ȫ��Ӧ��
�ʴ�Ϊ��������ȫ�ܽ�6.4 gͭ��Ũ�����Ũ�Ȼ��淴Ӧ�Ľ��м�С����Ϊϡ�������ͭ��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼Ԫ���γɵĵ��ʺͻ������ڻ��������ϡ�ҽѧ������Ӧ�ù㷺���ش��������⣺
(1)���ֽ��ʯ������̼��ɿ��Ŀ�ѧ����Ϊ___________����̬Cԭ�Ӻ���δ�ɶԵ��ӵ���ĿΪ_____________��
(2)������ṹΪ ��
��
�ٿ�������Cԭ�ӵ��ӻ���ʽΪ_________________��
��1 mol������������![]() ����ĿΪ_________________��
����ĿΪ_________________��
�ۿ�����ͨ����ˮ�е��ܽ�Ƚ�С����������![]() ����������ˮ���ܽ�ȵ�ԭ��Ϊ_________________��
����������ˮ���ܽ�ȵ�ԭ��Ϊ_________________��
��CH3+(��������)�����幹��Ϊ_________________��
(3)CO��NO��H2S��Ϊ������ϵ�����źŷ��ӡ�����H��C��O��S�ĵ縺���ɴ�С��˳��Ϊ____________��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ________________��
(4)�ɱ��������˹����ꡣ���۵���ڽ��ʯ��ԭ��Ϊ___________�����ɱ����ܶ�Ϊ1.56 g/cm3��������������Ϊ0.57 nm����ÿ������ʵ��ռ��CO2����ĿΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״���
������ΪCu2O/ZnO����CO(g)��2H2(g)![]() CH3OH(g)���״������ʵ������¶ȵĹ�ϵ����ͼ��ʾ�����з�����ȷ���� �� ��
CH3OH(g)���״������ʵ������¶ȵĹ�ϵ����ͼ��ʾ�����з�����ȷ���� �� ��
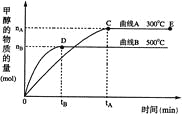
A. ��Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽ K��c(CH3OH)/c(CO)��c2(H2)
B. �����¶ȣ�Kֵ����
C. ��500�����ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��3tB/2nBmol��(L��min)��1
D. �����������䣬E������ѹ����ԭ����1/2������ƽ��ʱn(H2)/n(CH3OH)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ױƷ�����Z��������Ч��ԭ������������ȡ���ֿ������·�Ӧ�Ʊ��������й�������ȷ���ǣ� ��
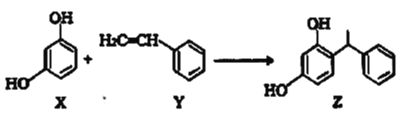
A.Z�ķ���ʽΪ![]()
B.X��Y����������ԭ�Ӷ����ܴ���ͬһƽ��
C.Y�ı����϶�����ﹲ��10��
D.X��Y��Z����ʹ��ˮ��ɫ����ɫԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��ԭ��������������W��X������������֮����Z��2����X��ԭ�Ӱ뾶��ͬ������������Ԫ������С�ģ�W��X�ļ���̬�⻯�������![]() ������ͬ�ĵ�������
������ͬ�ĵ�������
����˵����ȷ���ǣ� ��
A.�����Ӱ뾶��![]()
B.X��Y����Ԫ���γɵĻ�����ˮ��Һ�ʼ���
C.Y��Z���������֮����X�����
D.W���⻯����W��������֮��һ�����ܷ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL 0.1mol/LHX��Һ����μ���0.2molL1YOH��Һ�������Һ��pH�仯�����ͼ��ʾ(�¶Ⱥ�����仯���Բ���)�������н�����ȷ����( )
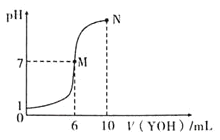
A.M�㲻���ڣ�c(Y+)=c(X-)
B.N��ˮ�ĵ���̶ȴ���M��ˮ�ĵ���̶�
C.25��ʱpH=4��YX��Һ�е������c(H+)=1.0��![]()
D.N���Ӧ��Һ������Ũ�ȹ�ϵ���ڣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��19.2 g Cu���뵽100 mLһ��Ũ�ȵ�������Һ�У��ٶ�����ǡ����ȫ��Ӧ��ͬʱ������״����8.96 L NO��NO2�Ļ������(����������ܽ⼰ת��)����
(1)���������NO��NO2������ȡ�_____________
(2)������Һ�����ʵ���Ũ�ȡ�__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)��5O2(g) ![]() 4NO(g)��6H2O(g)������������ȷ����(����)
4NO(g)��6H2O(g)������������ȷ����(����)
A. �ﵽ��ѧƽ��ʱ4v��(O2)��5v��(NO)
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v��(NH3)��3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ҵ�����Ϳ�����������Ҫ����;����ش��������⣺
��1����̬ Ni ԭ���У���������������ߵ��ܼ�����Ϊ_________���۲���ӵĹ������ʽΪ_________��
��2��Ni�����������ṹ��ͼ��ʾ��
A B
��A ���ۡ��е����B��ԭ��Ϊ_________��
��A���庬�л�ѧ��������Ϊ___________����ѡ����ĸ����
A������ B������ C����� D��������
��A������Nԭ�ӵ��ӻ���ʽ��_________��
��3�� �˹��ϳɵ��黯�������ڸ���ȱ�ݣ�ijȱ���黯�������ΪNi1.2As�� ���� Ni Ԫ��ֻ�У�2 �ͣ�3 ���ּ�̬�� ���ּ�̬����������Ŀ֮��Ϊ_________��
��4�� NiAs�ľ����ṹ��ͼ��ʾ��

�������ӵ���λ��Ϊ_________��
���������ӵ�������ֵΪNA�������ܶ�Ϊ �� g��cm��3����þ����������������֮��ľ���Ϊ_________pm��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com