
【题目】下列关于胶体的说法正确的是
A. 向Al(OH)3胶体中加入NaOH溶液至过量,有沉淀产生
B. 由于胶体带电,在电场的作用下可以在分散剂中做定向运动
C. 可用渗析的方法除去淀粉溶液中的NaCl
D. 制备Fe(OH)3胶体时需要将饱和FeCl3溶液与NaOH溶液混合
【答案】C
【解析】
A.NaOH溶液是电解质能使胶体发生聚沉生成Al(OH)3沉淀,继续滴加Al(OH)3沉淀可与氢氧化钠反应生成偏铝酸钠,沉淀溶解,故A错误;B.胶体是电中性分散系,胶体微粒吸附带电离子,通电发生定向移动,故B错误;C.氯化钠溶液能透过半透膜而胶体不能,故可用渗析的方法除去淀粉溶液中的NaCl,故C正确;D.实验室制备氢氧化铁胶体,是在沸腾的蒸馏水中加入饱和氯化铁溶液加热,当溶液变为红褐色时应立即停止加热,即可以得到氢氧化铁胶体,反应为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl,将饱和FeCl3溶液滴入NaOH溶液中振荡,生成Fe(OH)3沉淀,故D错误;故选C。
Fe(OH)3(胶体)+3HCl,将饱和FeCl3溶液滴入NaOH溶液中振荡,生成Fe(OH)3沉淀,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】将2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)反应设计的原电池如图所示。请回答下列问题:
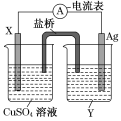
(1)电极X的材料是____,电解质溶液Y是____。
(2)外电路中的电子是从_____电极流向_____电极。
(3)银电极上发生的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。

回答下列问题:
(1)写出下列各物质的化学式:X____、Y_____、A_____、B_____、C____。
(2)反应①的的化学方程式为_____,反应②的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
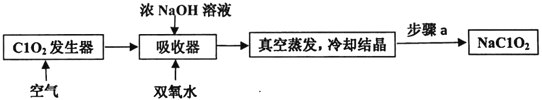
下列说法不正确的是
A. 步骤a的操作包括过滤、洗涤和干燥
B. 吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2-+O2↑+2H+
C. 工业上可将ClO2制成NaClO2固体,便于贮存和运输
D. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图的实验装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
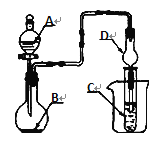
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为稀盐酸,B为石灰石,C中盛CaCl2溶液,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硝酸,B为铜屑,C中盛紫色石蕊溶液,则C中溶液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
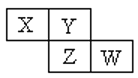
A. 原子半径:X<Z<W
B. 最高化合价:X<Y
C. 非金属性:Z>Y
D. 最高价氧化物对应水化物的酸性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
I.将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)能使化学反应速率加快的措施有________(填序号)。
①升高反应温度②增加C的物质的量③密闭定容容器中充入CO(g)
II.工业上用CO生产燃料甲醇,一定条件下发生反应CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
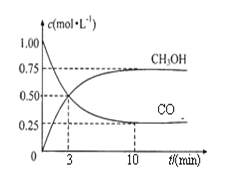
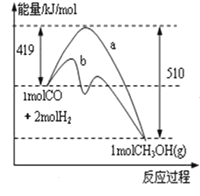
图1 图2
(2)图1是表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=__________________;
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。请结合图像解释催化剂加快化学反应速率的原因_______________________________,该反应消耗1molCO时,______(填“放出”或“吸收”)__________KJ热量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com