
【题目】下列各组中的离子,能在溶液中大量共存的是
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化:CH4(g)+ ![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
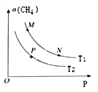
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_________。
②M、N两点的H2的物质的量浓度c(M)______c(N)(填“>”“<”或“=”)。
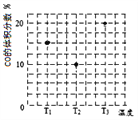
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g)![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
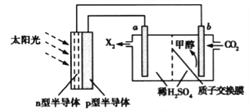
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为___________________;当电路中有3mol电子转移时,质子交换膜两侧溶液相差_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
A. AlCl3和NaOH B. Fe和Cl2 C. Na和O2 D. Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和B是同周期的相邻元素,B和C是同主族的相邻元素,且A,B,C最外层电子数之和为19,则A,B,C三种元素按照顺序是( )
A.N,F,Cl
B.F,O,S
C.S,Cl、O
D.S,O,F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种元素都是短周期元素.A元素的离子具有黄色的焰色反应.B元素的离子结构和Ne具有相同的电子层排布;5.8g B的氢氧化物恰好能与100mL 2mol/L盐酸完全反应;B原子核中质子数和中子数相等.H2在C单质中燃烧产生苍白色火焰.D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍.根据上述条件,回答:
(1)元素C的最高价氧化物的化学式为 .
(2)写出元素名称A , B .
(3)A与D形成稳定的化合物的化学式为 .
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。请回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子的核外价电子排布式为_______,S、O、N三种元素的第一电离能由大到小的顺序为 __________。
(2)NO3-的立体构型是_____,与NO3-互为等电子体的一种非极性分子为 _________(填化学式)。
(3)CuSO4的熔点为560°C,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是_____。
(4)往CuSO4溶液中加人过量NaOH能生成配合物[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为(用箭头表示出配位键的位置)_______。
(5)化学实验室常利用新制氢氧化铜检验醛基的存在,乙醛分子中碳原子的杂化方式为 ___。
(6)利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如下图所示。
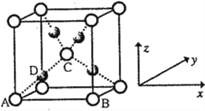
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
, ![]() ,
, ![]() )。则D原子的坐标参数为________,它代表_______原子。
)。则D原子的坐标参数为________,它代表_______原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物在工业上有重要的应用.
(1)FeCl3净水的原理是(用离子方程式表示)_________________.FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)________________.
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2废液得到FeCl3.
①若酸性FeCl2废液中c(Fe2+)=2.0×10﹣2molL﹣1,c(Fe3+)=1.0×10﹣3molL﹣1,c(Cl﹣)=5.3×10﹣2molL﹣1,则该溶液的PH约为_____.
②完成NaClO3 氧化FeCl2 的离子方程式:
ClO3﹣ +___Fe2+ +___ ____= __Cl﹣ + ___Fe3++ __ ____.
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,工业上用湿法制备K2FeO4的流程如图1所示:反应③加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明__________________________.某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO﹣与ClO3﹣离子的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为_____.
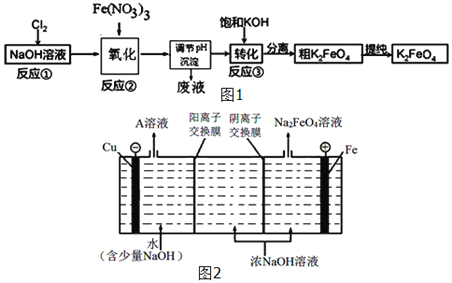
(4)工业上还可用通过电解浓NaOH溶液来制备Na2FeO4,其工作原理如图2所示:阳极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法正确的是()
A.除去溴苯中混有的少量溴单质:加入足量的氢氧化钠溶液,振荡静置分液
B.除去苯中少量的苯酚:加溴水,振荡,过滤除去沉淀
C.除去乙醇中的微量水,可加入金属钠,使其完全反应
D.除去乙酸乙酯中的乙酸,加入碳酸钠溶液洗涤,分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com