
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。请回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子的核外价电子排布式为_______,S、O、N三种元素的第一电离能由大到小的顺序为 __________。
(2)NO3-的立体构型是_____,与NO3-互为等电子体的一种非极性分子为 _________(填化学式)。
(3)CuSO4的熔点为560°C,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是_____。
(4)往CuSO4溶液中加人过量NaOH能生成配合物[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为(用箭头表示出配位键的位置)_______。
(5)化学实验室常利用新制氢氧化铜检验醛基的存在,乙醛分子中碳原子的杂化方式为 ___。
(6)利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如下图所示。
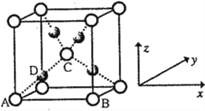
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
, ![]() ,
, ![]() )。则D原子的坐标参数为________,它代表_______原子。
)。则D原子的坐标参数为________,它代表_______原子。
【答案】 3d9 N>O>S 平面三角形 BF3(或BCl3、BBr3等) CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高 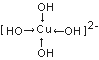 SP3、SP2 (
SP3、SP2 (![]() ;
;![]() ;
;![]() ) Cu
) Cu
【解析】(1)Cu2+电子排布式为[Ar]3d9,价电子排布式为3d9;同周期主族元素的第一电离能,随着原子序数的增大,有增大的趋势,但第VA族大于第VIA族元素,同主族元素,随着原子序数的增加,第一电离能逐渐减小,则S、O、N三种元素的第一电离能由大到小的顺序为:N>O>S;(2)对于NO3-,根据VSEPR理论,中心N原子的配位原子数为3,孤电子对数为![]() =0,则价电子对数为3+0=3,根据杂化轨道理论,中心N原子为sp2杂化,则其空间构型为平面三角形;等电子体是指原子数目相同,价电子数相同的粒子,则与NO3-互为等电子体的粒子有BF3,或BCl3,BBr3;(3)CuSO4的熔点为560°C,Cu(NO3)2的熔点为115℃,二者都是离子晶体,晶格能越大,熔点越高,晶格能和离子半径和离子电荷有关,离子电荷越高,半径越小,则: CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(4)往CuSO4溶液中加人过量NaOH能生成配合物[Cu(OH)4]2-,为配离子,OH-与Cu2+之间是配位键,用箭头表示,则不考虑空间构型[Cu(OH)4]2-的结构可用示意图表示为
=0,则价电子对数为3+0=3,根据杂化轨道理论,中心N原子为sp2杂化,则其空间构型为平面三角形;等电子体是指原子数目相同,价电子数相同的粒子,则与NO3-互为等电子体的粒子有BF3,或BCl3,BBr3;(3)CuSO4的熔点为560°C,Cu(NO3)2的熔点为115℃,二者都是离子晶体,晶格能越大,熔点越高,晶格能和离子半径和离子电荷有关,离子电荷越高,半径越小,则: CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(4)往CuSO4溶液中加人过量NaOH能生成配合物[Cu(OH)4]2-,为配离子,OH-与Cu2+之间是配位键,用箭头表示,则不考虑空间构型[Cu(OH)4]2-的结构可用示意图表示为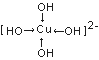 ;(5)乙醛分子的结构式为:
;(5)乙醛分子的结构式为: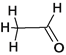 ,醛基为平面型,甲基为四面体型,则C的杂化方式有SP3、SP2;(6)①根据Cu2O的晶胞结构,已知A、B、C的原子坐标分别为(0,0,0),B(1,0,0),C(
,醛基为平面型,甲基为四面体型,则C的杂化方式有SP3、SP2;(6)①根据Cu2O的晶胞结构,已知A、B、C的原子坐标分别为(0,0,0),B(1,0,0),C(![]() ,
,![]() ,
,![]() ),根据立体几何知识,正四面体构型,D原子在AC之间的一半处,则D的原子坐标为(
),根据立体几何知识,正四面体构型,D原子在AC之间的一半处,则D的原子坐标为(![]() ,
,![]() ,
,![]() ),根据晶胞内粒子数目的关系,白色的原子有8×
),根据晶胞内粒子数目的关系,白色的原子有8×![]() +1=2个,黑色的原子有4个,因此D原子为Cu。
+1=2个,黑色的原子有4个,因此D原子为Cu。


科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
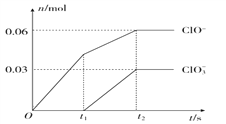
A. 反应中转移电子的物质的量是0.21mol
B. 一定有3. 36L氯气参加反应
C. 苛性钾溶液中KOH的质量是16.8g
D. ClO的生成可能是由于温度升高引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素且其焰色反应为黄色.Y和W的最外层电子数相等.Y,Z两元素原子的质子数之和为W,X两元素质子数之和的3倍且Z的单质为淡黄色固体.由此可知:
(1)写出元素符号W , Z .
(2)W2X的电子式为 .
(3)由Y,X,W组成的化合物中有键和键.
(4)由W,X,Y,Z四种元素组成的化合物的化学式为 , ;写出这两种物质之间反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN 等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯睛(C3H3N)和副产物丙烯醛(CH2=CHCHO)的热化学方程式如下:
① C3H6(g)+NH3(g)+O2(g)=C3H3N(g)+3H2O(g)△H=-515kJ/mol
② C3H6(g)+O2(g)=C3H4O(g)+H2O(g) △H=-353kJ/mol
有利于提高丙烯腈平衡产率的反应条件是______;提高丙烯腈反应选择性的关键因素是_____.
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是_____;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D. 反应活化能增大

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为_________ ,理由是_______。进料氨、空气、丙烯的理论体积约为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层电子排布图____________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为________,B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是___________;C、D和E的电负性由大到小的顺序为___________;C、D和E的第一电离能由大到小的顺序是____________;C和D最高价含氧酸的酸性由弱到强的顺序为_________________。CO![]() 中C的杂化方式为___________,该离子的“VSEPR”模型为__________________形。
中C的杂化方式为___________,该离子的“VSEPR”模型为__________________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_______,该离子的配位体为________________。
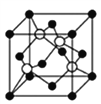
(4)D(黑球)和F(白球)形成的某种晶体的晶胞如下图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3(精确到0.1),最近的黑球和白球之间的距离为_______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是( )
A. Fe3+ B. Mg2+ C. Fe2+ D. Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com