
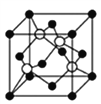
����Ŀ��ǰ������Ԫ��A��B��C��D��E��F��ԭ��������������A�������к�����ḻ��Ԫ�أ�B��Cͬһ���壬��B��L���������K���������2.5����D��Cͬһ���ڣ�EԪ��ԭ�Ӻ��������17�ֲ�ͬ���˶�״̬��Fλ�ڵ������ڣ���δ�ɶԵ�����ֻ��һ�������ڲ㶼����ȫ����״̬����ش��������⣺
��1��Bԭ�ӵ�L������Ų�ͼ____________��
��2����A��Bԭ���γɵķ��ӵĽṹʽΪ��A-B=B-A����÷�������������������Ŀ֮��Ϊ________��B��C���⻯����BH3�ķе���� CH3�ķе㣬ԭ����___________��C��D��E�ĵ縺���ɴ�С��˳��Ϊ___________��C��D��E�ĵ�һ�������ɴ�С��˳����____________��C��D��ۺ����������������ǿ��˳��Ϊ_________________��CO![]() ��C���ӻ���ʽΪ___________�������ӵ���VSEPR��ģ��Ϊ__________________�Ρ�
��C���ӻ���ʽΪ___________�������ӵ���VSEPR��ģ��Ϊ__________________�Ρ�
��3����FDO4��Һ�м������ϡ��ˮ���õ�������ɫ��Һ�������ӻ�ѧʽΪ_______�������ӵ���λ��Ϊ________________��
��4��D������F�������γɵ�ij�־���ľ�������ͼ��ʾ����֪�þ������ⳤΪ516 pm����þ������ܶ�Ϊ___________g/cm3����ȷ��0.1��������ĺ���Ͱ���֮��ľ���Ϊ_______pm��
���𰸡� ![]() 3�U1 NH3���Ӽ�����γ���� Cl>S>P Cl>P>S H3PO4��H2SO4 sp3�ӻ� �������� [Cu(NH3)4]2+ NH3 4.6 129
3�U1 NH3���Ӽ�����γ���� Cl>S>P Cl>P>S H3PO4��H2SO4 sp3�ӻ� �������� [Cu(NH3)4]2+ NH3 4.6 129![]()
��������ǰ������Ԫ��A��B��C��D��E��F��ԭ��������������A�������к�����ḻ��Ԫ�أ�AΪHԪ�أ�B��Cͬһ���壬��B��L���������K���������2.5����BΪNԪ�أ�CΪPԪ�أ�EԪ��ԭ�Ӻ��������17�ֲ�ͬ���˶�״̬��EΪClԪ�أ�Fλ�ڵ������ڣ���δ�ɶԵ�����ֻ��һ�������ڲ㶼����ȫ����״̬��FΪͭԪ�أ�C��D��E��ԭ��������������DΪSԪ�أ���A-H��B-N��C-P��D-S��E-Cl��F-Cu��
��1��BΪNԪ�أ�ԭ�ӵ�L��5�����ӣ������Ų�ͼ��![]() ����2����A��Bԭ���γɵķ��ӵĽṹʽΪ��H-N=N-H����÷�������������������Ŀ֮��Ϊ3��1��B��C���⻯����NH3�ķе���� PH3�ķе㣬ԭ����NH3���Ӽ�����γ���������Ӽ��������е������Ԫ�����ڱ��У�ͬһ����Ԫ�صĵ縺�Դ�����������ͬһ����Ԫ�صĵ縺�Դ��ϵ�����С��C��D��E�ĵ縺���ɴ�С��˳��ΪCl>S>P����Ԫ�����ڱ��У�ͬһ����Ԫ�صĵ�һ�����ܴ�����������ͬһ����Ԫ�صĵ�һ�����ܴ��ϵ�����С�������ڳ����Ͱ����״̬ʱ����һ�����ܱ��C��D��E�ĵ�һ�������ɴ�С��˳����Cl>P>S����Ԫ�����ڱ��У�ͬһ����Ԫ�ص���ۺ��������������ǿ��C��D��ۺ����������������ǿ��˳��ΪH3PO4��H2SO4 ��PO43����P�µ��Ӷ�Ϊ
����2����A��Bԭ���γɵķ��ӵĽṹʽΪ��H-N=N-H����÷�������������������Ŀ֮��Ϊ3��1��B��C���⻯����NH3�ķе���� PH3�ķе㣬ԭ����NH3���Ӽ�����γ���������Ӽ��������е������Ԫ�����ڱ��У�ͬһ����Ԫ�صĵ縺�Դ�����������ͬһ����Ԫ�صĵ縺�Դ��ϵ�����С��C��D��E�ĵ縺���ɴ�С��˳��ΪCl>S>P����Ԫ�����ڱ��У�ͬһ����Ԫ�صĵ�һ�����ܴ�����������ͬһ����Ԫ�صĵ�һ�����ܴ��ϵ�����С�������ڳ����Ͱ����״̬ʱ����һ�����ܱ��C��D��E�ĵ�һ�������ɴ�С��˳����Cl>P>S����Ԫ�����ڱ��У�ͬһ����Ԫ�ص���ۺ��������������ǿ��C��D��ۺ����������������ǿ��˳��ΪH3PO4��H2SO4 ��PO43����P�µ��Ӷ�Ϊ![]() =0������Ϊ4���۵��Ӷ�Ϊ4��PO43����P���ӻ���ʽΪ sp3�ӻ��������ӵ���VSEPR��ģ��Ϊ���������Ρ���3����CuSO4��Һ�м������ϡ��ˮ���õ�������ɫ��Һ�������ӻ�ѧʽΪ[Cu(NH3)4]2+��NH3��Nԭ���ṩ�µ��Ӷԣ������ӵ���λ��ΪNH3����4��DΪS������FΪͭ�������γɵ�ij�־���ľ����У�Sԭ��8��1/8+6��1/2=4,ͭΪ4����֪�þ������ⳤΪ516 pm����þ������ܶ�Ϊ
=0������Ϊ4���۵��Ӷ�Ϊ4��PO43����P���ӻ���ʽΪ sp3�ӻ��������ӵ���VSEPR��ģ��Ϊ���������Ρ���3����CuSO4��Һ�м������ϡ��ˮ���õ�������ɫ��Һ�������ӻ�ѧʽΪ[Cu(NH3)4]2+��NH3��Nԭ���ṩ�µ��Ӷԣ������ӵ���λ��ΪNH3����4��DΪS������FΪͭ�������γɵ�ij�־���ľ����У�Sԭ��8��1/8+6��1/2=4,ͭΪ4����֪�þ������ⳤΪ516 pm����þ������ܶ�Ϊ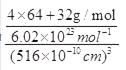 =
=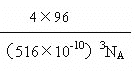 g/cm3 =4.6g/cm3����ȷ��0.1����������ⳤaΪ516 pm���ĸ�ͭ�����������ĸ�С����������ģ���ͭԭ����ױ������ߣ������ڵ���ֱ�������Σ����߷ֱ�Ϊ
g/cm3 =4.6g/cm3����ȷ��0.1����������ⳤaΪ516 pm���ĸ�ͭ�����������ĸ�С����������ģ���ͭԭ����ױ������ߣ������ڵ���ֱ�������Σ����߷ֱ�Ϊ![]() a��
a��![]() a,�����б��Ϊ
a,�����б��Ϊ![]() a,����ĺ���Ͱ���֮��ľ���Ϊ
a,����ĺ���Ͱ���֮��ľ���Ϊ![]() ��516 pm=129
��516 pm=129![]() pm��
pm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3���ִ���ҵ����Ӧ�ù㷺��ij��ѧ�о���ѧϰС��ģ�ҵ�����Ʊ���ˮFeCl3�����ø���ƷFeCl3��Һ�����ж���H2S��
��.���������ϵ�֪����ˮFeCl3�ڿ������׳��⣬����������������������Ʊ���ˮFeCl3��ʵ�鷽����װ��ʾ��ͼ(���ȼ��г�װ����ȥ)�������������£�
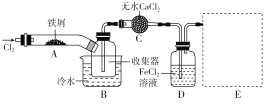
�ټ���װ�õ������ԣ� ��ͨ������Cl2���Ͼ�װ���еĿ�����
���þƾ�������м�·���������Ӧ��ɣ� ������
����ϵ��ȴ��ֹͣͨ��Cl2�����ø����N2�Ͼ�Cl2�����ռ����ܷ⡣
��ش��������⣺
(1)װ��A�з�Ӧ�Ļ�ѧ����ʽΪ____________________________________________��
(2)�ڢ۲����Ⱥ����ɵ���״FeCl3�ֽ����ռ��������������ڷ�Ӧ��A�Ҷˡ�Ҫʹ������FeCl3�����ռ������ڢܲ�������________��
(3)���������У�Ϊ��ֹFeCl3�������ȡ�Ĵ�ʩ��(������)________��
(4)װ��B����ˮԡ������Ϊ________��װ��C������Ϊ________��װ��D��FeCl2ȫ����Ӧ����ʧȥ����Cl2�����ö�ʧЧ��д������FeCl2�Ƿ�ʧЧ���Լ�____________��ͨ������FeCl2��ҺʱҪ����_______�Է�ֹ���������йط�Ӧ�����ӷ���ʽΪ________��
(5)�����߿��л���β������װ��E��ע���Լ�________��
��.����ͬѧ��װ��D�еĸ���ƷFeCl3��Һ����H2S���õ��������˺�����ʯīΪ�缫����һ�������µ����Һ��
(6)FeCl3��H2S��Ӧ�����ӷ���ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��ͬ���ڵ�����Ԫ�أ�B��C��ͬ���������Ԫ�أ���A��B��C����������֮��Ϊ19����A��B��C����Ԫ�ذ���˳���ǣ� ��
A.N��F��Cl
B.F��O��S
C.S��Cl��O
D.S��O��F
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��Cu(NO3)2����Ȼ������Ҫ��ͭ�Ρ���ش��������⣺
��1��CuSO4��Cu(NO3)2�������ӵĺ���۵����Ų�ʽΪ_______��S��O��N����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ __________��
��2��NO3-�����幹����_____����NO3-��Ϊ�ȵ������һ�ַǼ��Է���Ϊ _________(�ѧʽ)��
��3��CuSO4���۵�Ϊ560��C��Cu(NO3)2���۵�Ϊ115����CuSO4�۵���ߵ�ԭ����_____��
��4����CuSO4��Һ�м��˹���NaOH�����������[Cu��OH��4]2���������ǿռ乹�ͣ�[Cu��OH��4]2���Ľṹ����ʾ��ͼ��ʾΪ���ü�ͷ��ʾ����λ����λ�ã�_______��
��5����ѧʵ���ҳ���������������ͭ����ȩ���Ĵ��ڣ���ȩ������̼ԭ�ӵ��ӻ���ʽΪ ___��
��6���������Ƶ�Cu(OH)2����ȩ��ʱ�����ɺ�ɫ��Cu2O,�侧���ṹ����ͼ��ʾ��
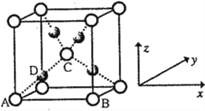
�þ���ԭ���������AΪ��0,0,0)��BΪ��1,0,0����CΪ��![]() ��
�� ![]() ��
�� ![]() ������Dԭ�ӵ��������Ϊ________��������_______ԭ�ӡ�
������Dԭ�ӵ��������Ϊ________��������_______ԭ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ˮ��˵���У�����ȷ����( )
A. ��ˮ�Ǵ����� B. ������ˮ������
C. ������ˮ����Ư������ D. ������ˮӦ�ܹⱣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ������ڹ�ҵ������Ҫ��Ӧ�ã�
��1��FeCl3��ˮ��ԭ���ǣ������ӷ���ʽ��ʾ��_________________��FeCl3��Һ��ʴ�����豸����H+�����⣬��һ��Ҫԭ���ǣ������ӷ���ʽ��ʾ��________________��
��2��Ϊ��Լ�ɱ�����ҵ����NaClO3 ��������FeCl2��Һ�õ�FeCl3��
��������FeCl2��Һ��c��Fe2+��=2.0��10��2molL��1��c��Fe3+��=1.0��10��3molL��1��c��Cl����=5.3��10��2molL��1�������Һ��PHԼΪ_____��
�����NaClO3 ����FeCl2 �����ӷ���ʽ��
��ClO3�� +___Fe2+ +___ ____= __Cl�� + ___Fe3++ __ ____��
��3��������أ�K2FeO4����һ�����͡���Ч�����ˮ���������Ҳ�����ɶ�����Ⱦ����֪�����������ȶ��Բ��ҵ����ʪ���Ʊ�K2FeO4��������ͼ1��ʾ����Ӧ�ۼ���ŨKOH��Һ������������أ�K2FeO4������˵��__________________________��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ��õ�NaCl��NaClO��NaClO3�Ļ����Һ�����ⶨClO����ClO3�����ӵ����ʵ���֮����1��2����Cl2���������Ʒ�Ӧʱ������ԭ����Ԫ�غͱ���������Ԫ�ص����ʵ���֮��Ϊ_____��
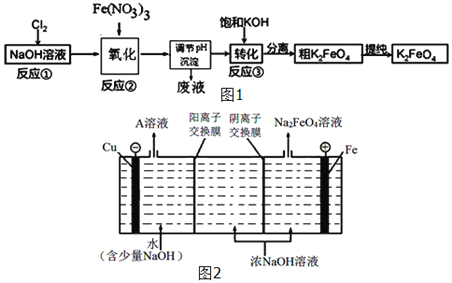
��4����ҵ�ϻ�����ͨ�����ŨNaOH��Һ���Ʊ�Na2FeO4���乤��ԭ����ͼ2��ʾ�������ĵ缫��ӦʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
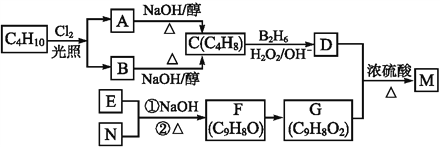
����Ŀ���л���M��һ��ʳƷ����,����C4H10Ϊԭ��ͨ������·�ߺϳ�:
��֪:��R��CH![]() CH2
CH2![]() R��CH2CH2OH
R��CH2CH2OH
��RCH2CHO+R'CH2CHO![]()
![]()
![]()
![]()
��F�����е�̼����û��֧��;EΪ�����廯������E��N���ܷ���������Ӧ��
��ش���������:
��1��A��B��Ϊһ�ȴ���,д������һ�ֵ�����(ϵͳ����)____;M�еĹ���������Ϊ______��
��2��д�����з�Ӧ�ķ�Ӧ����:F��G________,D+G![]() M________��
M________��
��3��F������Cu(OH)2/NaOH(aq)��Ӧ�Ļ�ѧ����ʽΪ____________________��
��4��M�Ľṹ��ʽΪ____________;E�ĺ˴Ź���������____�ַ塣
��5����G������ͬ�����ŵ�G�ķ�����ͬ���칹����____��,��д������һ�ֵĽṹ��ʽ:________________��
��6�����������ϳ�·��,�Ա���ϩ(![]() )����ȩΪԭ��(���Լ���ѡ),����Ʊ�
)����ȩΪԭ��(���Լ���ѡ),����Ʊ�
![]() �ĺϳ�·����______________________��
�ĺϳ�·����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī���缫���������Һ
��ϡH2SO4��K2SO4��Һ����NaCl��Һ����CuSO4��Һ����KOH��Һ
(1)������������������������������(��ͬ������)Ϊ2��1����(�����)_______��
(2)�����������������������������ҺpH������________��(�����)
(3)һ���缫����������һ���缫�ݳ����壬����ҺpH���Լ�С����________ (�����)�����ܷ�Ӧ�Ļ�ѧ����ʽ��____________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com