
【题目】A和B是同周期的相邻元素,B和C是同主族的相邻元素,且A,B,C最外层电子数之和为19,则A,B,C三种元素按照顺序是( )
A.N,F,Cl
B.F,O,S
C.S,Cl、O
D.S,O,F
【答案】B
【解析】解:A和B是同周期的相邻元素,B和C是同主族的相邻元素,且A、B、C最外层电子数之和为19,则在周期表中可能存在以下几种位置: 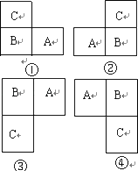
①设A的最外层电子数为x,则B、C的最外层电子数都为x﹣1,则有x+x﹣1+x﹣1=19,x=7,则A为Cl,B为S,C为O;
②设A的最外层电子数为x,则B、C的最外层电子数都为x+1,则有x+x+1+x+1=19,x= ![]() ,不符合题意;
,不符合题意;
③设A的最外层电子数为x,则B、C的最外层电子数都为x﹣1,则有x+x﹣1+x﹣1=19,x=7,则A为F,B为O,C为S;
④设A的最外层电子数为x,则B、C的最外层电子数都为x+1,则有x+x+1+x+1=19,x= ![]() ,不符合题意,
,不符合题意,
故选B.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是;2Cu2O+ Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+的价电子轨道表示式为__________________;Cu2O与Cu2S比较,熔点较高的是_______,原因为_____________________________________。
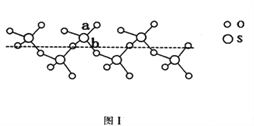
(2)SO2与SO3的键角相比,键角更大的是____________。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图1所示。此固态SO3中S原子的杂化轨道类型是_______;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为_________(填图中字母)。
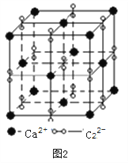
(3)离子化合物CaC2的一种晶体结构如下图2所示。写出该物质的电子式_____。从钙离子看,属于____________堆积;一个晶胞含有的π键平均有______个。

(4)奥氏体是碳溶解在γ—Fe中形成的一种间隙固溶体,无磁性,其晶胞如上图3所示,则该物质的化学式为________,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为____________________ pm。(阿伏加德罗常数的值用NA表示,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
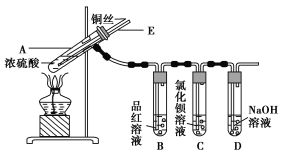
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为 。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是 。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 |
写出其中SO2表现还原性的离子反应方程式: 。
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是 。
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是 。
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体 mol(不考虑溶解的SO2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
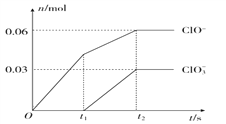
A. 反应中转移电子的物质的量是0.21mol
B. 一定有3. 36L氯气参加反应
C. 苛性钾溶液中KOH的质量是16.8g
D. ClO的生成可能是由于温度升高引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素且其焰色反应为黄色.Y和W的最外层电子数相等.Y,Z两元素原子的质子数之和为W,X两元素质子数之和的3倍且Z的单质为淡黄色固体.由此可知:
(1)写出元素符号W , Z .
(2)W2X的电子式为 .
(3)由Y,X,W组成的化合物中有键和键.
(4)由W,X,Y,Z四种元素组成的化合物的化学式为 , ;写出这两种物质之间反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
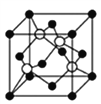
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层电子排布图____________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为________,B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是___________;C、D和E的电负性由大到小的顺序为___________;C、D和E的第一电离能由大到小的顺序是____________;C和D最高价含氧酸的酸性由弱到强的顺序为_________________。CO![]() 中C的杂化方式为___________,该离子的“VSEPR”模型为__________________形。
中C的杂化方式为___________,该离子的“VSEPR”模型为__________________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_______,该离子的配位体为________________。
(4)D(黑球)和F(白球)形成的某种晶体的晶胞如下图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3(精确到0.1),最近的黑球和白球之间的距离为_______pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com