
【题目】氯化硫酰![]() 主要用作氯化剂.它是一种无色液体,熔点
主要用作氯化剂.它是一种无色液体,熔点![]() ,沸点
,沸点![]() ,遇水生成硫酸和氯化氢.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
,遇水生成硫酸和氯化氢.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:![]()
(1)为了提高上述反应中![]() 的平衡转化率,下列措施合理的是 ______
的平衡转化率,下列措施合理的是 ______ ![]() 用编号填空
用编号填空![]() .
.
A.缩小容器体积![]() 使用催化剂
使用催化剂![]() 增加
增加![]() 浓度
浓度![]() 升高温度
升高温度
(2)![]() 时,体积为1L的密闭容器中充入
时,体积为1L的密闭容器中充入![]()
![]() ,达到平衡时容器中含
,达到平衡时容器中含![]()
![]() ,则
,则![]() 时合成
时合成![]() 反应的平衡常数为 ______ .
反应的平衡常数为 ______ .
(3)已知某温度下,已知![]() ,
,![]() ,在
,在![]() 溶于水所得溶液中逐滴加入
溶于水所得溶液中逐滴加入![]() 稀溶液,当
稀溶液,当![]() 浓度为
浓度为![]() 时,浑浊液中
时,浑浊液中![]() 浓度与
浓度与![]() 浓度之比为 ______ .
浓度之比为 ______ .
(4)将(2)所得的平衡混合气溶于足量的![]() 溶液中,计算最终生成沉淀的质量是多少
溶液中,计算最终生成沉淀的质量是多少![]() 写出计算过程
写出计算过程![]() .______ .
.______ .
【答案】AC ![]()
![]()
![]() ,
,![]() 由S元素质量守恒,可得:
由S元素质量守恒,可得:![]() 的物质的量为
的物质的量为![]() 质量为:
质量为:![]()
【解析】
![]() 提高反应中
提高反应中![]() 的平衡转化率,改变条件使平衡向正反应移动,根据平衡移动原理结合选项分析解答,注意不能增大氯气的用量;
的平衡转化率,改变条件使平衡向正反应移动,根据平衡移动原理结合选项分析解答,注意不能增大氯气的用量;
![]() 根据
根据![]() 计算
计算![]() 的物质的量,由方程式可知,
的物质的量,由方程式可知,![]() 的物质的量等于
的物质的量等于![]() 的物质的量,计算二者的浓度,代入平衡常数表达式
的物质的量,计算二者的浓度,代入平衡常数表达式![]() 计算;
计算;
![]() 氯化银的溶解度远远小于
氯化银的溶解度远远小于![]() 的溶解度,
的溶解度,![]() 溶于水所得溶液中
溶于水所得溶液中![]() :
:![]() :2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀,依据氯化银和硫酸银沉淀溶解平衡定量关系计算;
:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀,依据氯化银和硫酸银沉淀溶解平衡定量关系计算;
![]() 发生反应
发生反应![]() ,
,![]() ,
,![]() ,根据
,根据![]() 计算
计算![]() 的物质的量,由S元素质量守恒可得
的物质的量,由S元素质量守恒可得![]() ,再根据
,再根据![]() 计算硫酸钡的质量.
计算硫酸钡的质量.
![]() 提高反应中
提高反应中![]() 的平衡转化率,改变条件使平衡向正反应移动,不能增大氯气的用量,
的平衡转化率,改变条件使平衡向正反应移动,不能增大氯气的用量,
A.缩小容器体积,压强增大,平衡向正反应移动,![]() 的转化率增大,故A正确;
的转化率增大,故A正确;
B.使用催化剂,缩短到达平衡的时间,不影响平衡移动,![]() 的转化率不变,故B错误;
的转化率不变,故B错误;
C.增加![]() 浓度,平衡向正反应移动,
浓度,平衡向正反应移动,![]() 的转化率增大,故C正确;
的转化率增大,故C正确;
D.该反应正反应是放热反应,升高温度,平衡向逆反应移动,![]() 的转化率降低,故D错误;
的转化率降低,故D错误;
故答案为AC;
![]() 发生反应
发生反应![]() ,
,![]() 的物质的量为
的物质的量为![]() ,由方程式可知,
,由方程式可知,![]() ,二者浓度都为
,二者浓度都为![]() ,故参加反应的
,故参加反应的![]() 的物质的量为
的物质的量为![]() ,
,![]() 的物质的量为
的物质的量为![]() ,平衡时
,平衡时![]() 的物质的量为
的物质的量为![]() ,故
,故![]() 的平衡浓度为
的平衡浓度为![]() ,故
,故![]() 的合成
的合成![]() 反应的平衡常数为
反应的平衡常数为![]() ;
;
![]() 氯化银的溶解度远远小于
氯化银的溶解度远远小于![]() 的溶解度,
的溶解度,![]() 溶于水所得溶液中
溶于水所得溶液中![]() :
:![]() :2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀,当
:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀,当![]() 浓度为
浓度为![]() 时,浑浊液中
时,浑浊液中![]() 浓度与
浓度与![]() 浓度之比
浓度之比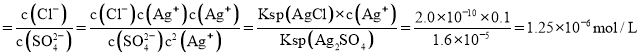 ;
;
![]() 发生反应
发生反应![]() ,
,![]() ,
,![]() ,
,![]() 的物质的量为
的物质的量为![]() ,由S元素质量守恒可得
,由S元素质量守恒可得![]() ,故硫酸钡的质量为
,故硫酸钡的质量为![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg和金属Cu的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛(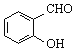 )和对羟基苯甲醛(
)和对羟基苯甲醛(![]() )的沸点
)的沸点
D. C-O和Si-O的键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或推理正确的是
A. 将Fe(N03)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(N03)2晶体已氧化变质
B. 常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9
C. 25℃时,Ksp(BaCO3)>Ksp(BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好
D. 将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1 mol·L1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×109]
A. 若将溶液不断加水稀释,则水的电离程度增大
B. 溶液中各离子浓度大小关系:c(Na+)> c(C2O42)> c(OH)> c(H+)> c(HC2O4)
C. 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=105
D. 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×108 mol·L1 时即能产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吗啡是严格查禁的毒品.吗啡分子含C71.58%,H6.67%,N4.91%,其余为O.已知其相对分子质量不超过300,则吗啡的分子式是
A.C17H19NO3B.C17H20N2OC.C18H19NO3D.C18H20N2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10g碳酸钙高温加热一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
A.生成了2g二氧化碳B.剩余固体质量为5g
C.生成了5.6g氧化钙D.剩余碳酸钙的质量为8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示。下列说法正确的是( )
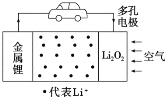
A.电解液中,Li+由多孔电极迁移向锂电极
B.该电池放电时,负极发生了还原反应
C.充电时,电池正极的反应式为Li2O2-2e-=2Li++O2↑
D.电池中的电解液可以是有机电解液或稀盐酸等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A. 同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B. BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C. BaSO4和BaCO3共存的悬浊液中, 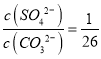
D. BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com