
【题目】取10g碳酸钙高温加热一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
A.生成了2g二氧化碳B.剩余固体质量为5g
C.生成了5.6g氧化钙D.剩余碳酸钙的质量为8g
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用下列装置进行相应实验,有关说法不正确的是
A.图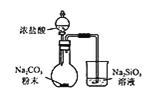 装置可验证酸性:
装置可验证酸性:![]()
B.图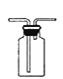 装置可用于收集气体
装置可用于收集气体![]()
C.图![]() 装置可用于分离
装置可用于分离![]() 萃取碘水后的有机层和水层
萃取碘水后的有机层和水层
D.图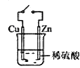 装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出
装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验现象得出的结论正确的是![]()
选项 | 实验操作 | 现象 | 结论 |
A | 废 | 得到澄清溶液 | X中一定不含 |
B | 浓度均为 | 产生黑色沉淀 |
|
C |
| 试纸变为蓝色 |
|
D |
| 有机相呈橙色 | 氧化性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫酰![]() 主要用作氯化剂.它是一种无色液体,熔点
主要用作氯化剂.它是一种无色液体,熔点![]() ,沸点
,沸点![]() ,遇水生成硫酸和氯化氢.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
,遇水生成硫酸和氯化氢.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:![]()
(1)为了提高上述反应中![]() 的平衡转化率,下列措施合理的是 ______
的平衡转化率,下列措施合理的是 ______ ![]() 用编号填空
用编号填空![]() .
.
A.缩小容器体积![]() 使用催化剂
使用催化剂![]() 增加
增加![]() 浓度
浓度![]() 升高温度
升高温度
(2)![]() 时,体积为1L的密闭容器中充入
时,体积为1L的密闭容器中充入![]()
![]() ,达到平衡时容器中含
,达到平衡时容器中含![]()
![]() ,则
,则![]() 时合成
时合成![]() 反应的平衡常数为 ______ .
反应的平衡常数为 ______ .
(3)已知某温度下,已知![]() ,
,![]() ,在
,在![]() 溶于水所得溶液中逐滴加入
溶于水所得溶液中逐滴加入![]() 稀溶液,当
稀溶液,当![]() 浓度为
浓度为![]() 时,浑浊液中
时,浑浊液中![]() 浓度与
浓度与![]() 浓度之比为 ______ .
浓度之比为 ______ .
(4)将(2)所得的平衡混合气溶于足量的![]() 溶液中,计算最终生成沉淀的质量是多少
溶液中,计算最终生成沉淀的质量是多少![]() 写出计算过程
写出计算过程![]() .______ .
.______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,H2还原WO3可得到钨,其总反应为:WO3+3H2![]() W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
温度(℃) | 25℃~550℃~600℃~700℃ |
主要成分 | WO3 W2O5 WO2 W |
A.1:1:4B.1:1:3C.1:1:2D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取大理石和稀盐酸反应后的废液50g,逐滴加入碳酸钠溶液,根据实验测得的数据绘出右图,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量。下列说法正确的是
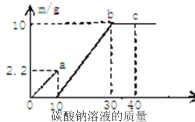
A.图中oa段表示生成的沉淀量
B.c点表示碳酸钠恰好完全反应
C.废液中盐酸的质量分数是7.3%
D.废液中含氯化钙0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中粒子浓度关系正确的是( )
A.0.01mol·L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-)
B.![]() =10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=c(10-2-10-12)mol·L-1
=10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=c(10-2-10-12)mol·L-1
C.等物质的量的NH4Cl和NaCl的混合溶液:c(NH4)+c(NH3·H2O)+c(Na+)=2c(Cl-)
D.0.1mol·L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车排放的尾气是大气污染气体之一。如何减少污染气体的排放是科学家研究的热门课题。请回答下列问题:
(1)已知:CO的燃烧热为283.0kJ·mol1,N2(g)+2O2(g) =2NO2(g) ΔH=+64kJ·mol1,则NO2(g)+2CO(g)=![]() N2(g)+2CO2(g) ΔH=___kJ·mol1,若反应中有14g还原剂发生反应,则转移电子___mol。
N2(g)+2CO2(g) ΔH=___kJ·mol1,若反应中有14g还原剂发生反应,则转移电子___mol。
(2)使汽车排放的CO和NO在一定条件下发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
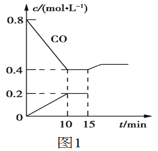
①该反应的化学平衡常数K=___。NO的平衡转化率=___。
②15min时,若改变反应条件,导致CO浓度发生如图1所示的变化,则改变的条件可能是___。
a.缩小容器体积b.增加CO2的量c.体积不变通入少量氩气d.加入催化剂
③当NO与CO的起始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图2所示,则下列说法正确的是___。
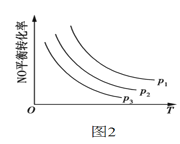
A.该反应ΔH<0 B.p1<p2<p3
C.升高温度正反应速率减小,逆反应速率增大 D.温度不变,增大压强,平衡常数增大
④以下说法中能判断反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)达到平衡的是___。
N2(g)+2CO2(g)达到平衡的是___。
A.反应物和生成物的物质的量相等 B.单位时间内消耗1molNO同时生成1molCO2
C.混合气体压强不再发生变化 D.NO的浓度不再变化
⑤向反应容器中再分别充入下列气体,能使NO转化率增大的是___。
A.O2 B.N2 C.CO D.NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),化工生产中常用MnS(s)作沉淀剂去除废水中的Cu2+。下列有关说法正确的是( )
CuS(s)+Mn2+(aq),化工生产中常用MnS(s)作沉淀剂去除废水中的Cu2+。下列有关说法正确的是( )
A.当c(Cu2+)=c(Mn2+)时该反应达到平衡
B.从该反应原理可以得出CuS的溶解度比MnS的溶解度大
C.该反应的平衡常数K=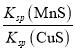
D.往平衡体系中加入少量CuSO4(s)后,c(Mn2+)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com