
【题目】下列根据实验现象得出的结论正确的是![]()
选项 | 实验操作 | 现象 | 结论 |
A | 废 | 得到澄清溶液 | X中一定不含 |
B | 浓度均为 | 产生黑色沉淀 |
|
C |
| 试纸变为蓝色 |
|
D |
| 有机相呈橙色 | 氧化性: |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】(1)甲醇![]() 是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备
是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备![]() 的反应:
的反应:![]() ,在体积为1L的恒容密闭容器中,充2molCO和
,在体积为1L的恒容密闭容器中,充2molCO和![]() ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得![]() 和
和![]() 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
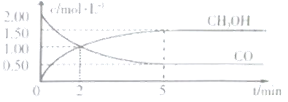
①从反应开始到5min,用一氧化碳表示的平均反应速率υ(CO)=______。
②下列说法正确的是______。
A.达到平衡时,![]() 的转化率为
的转化率为![]()
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氨气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应:
以体积比1:2置于密闭容器中发生反应:
![]() ,达到平衡时
,达到平衡时![]() 的体积分数为
的体积分数为![]() ,该反应的平衡常数
,该反应的平衡常数![]() ______。
______。
(3)碳与水蒸气反应制取![]() 的相关反应如下:
的相关反应如下:
Ⅰ![]()
Ⅱ![]()
Ⅲ![]()
①计算反应![]() 的
的![]() ______
______![]()
②对于可逆反应![]() ,采取以下措施可以提高
,采取以下措施可以提高![]() 产率的是______。
产率的是______。
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(4)以甲醇为燃料,![]() 为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
为氧化剂,KOH溶液为电解质溶液,可制成燃料电池![]() 电极材料为惰性电极
电极材料为惰性电极![]() 。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
(5)若往20mL![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
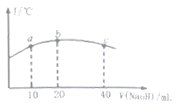
①该烧碱溶液的浓度为![]()
②该烧碱溶液的浓度为![]()
③![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点
点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Y | Z | W |
原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
![]() 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含![]() 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
![]() 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
![]() 完全燃烧放出的热量是
完全燃烧放出的热量是![]() ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
![]() 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系![]() 反应条件和其他物质已略
反应条件和其他物质已略![]()
![]()
![]() 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
![]() 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或推理正确的是
A. 将Fe(N03)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(N03)2晶体已氧化变质
B. 常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9
C. 25℃时,Ksp(BaCO3)>Ksp(BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好
D. 将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 代替
代替![]() 与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
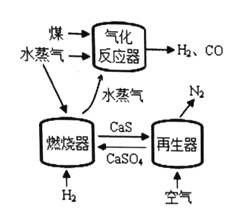
燃烧器中反应①![]() (主反应)
(主反应)
反应②![]() (副反应)
(副反应)
再生器中反应:![]()
(1)气化反应器中发生反应的化学方程式是 ______。
(2)燃烧器中![]() 物质的量分数随温度T、压强p
物质的量分数随温度T、压强p![]() 的变化曲线见图,从图中可以得出三条主要规律:
的变化曲线见图,从图中可以得出三条主要规律:
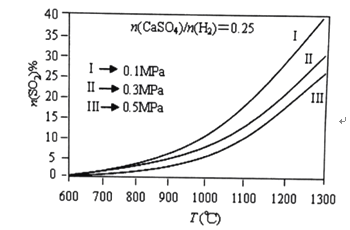
①其他条件不变,温度越高,![]() 含量越高;
含量越高;
②______ ;
③______ ;
由图可知,为减少![]() 的排放量,可采取的措施是 ______。
的排放量,可采取的措施是 ______。
(3)该燃烧技术中可循环的物质除![]() 、CaS外,还有 ______
、CaS外,还有 ______ ![]() 写名称
写名称![]() 。
。
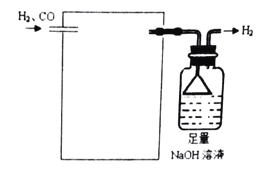
(4)欲采用氯化钯![]() 溶液除去
溶液除去![]() 中的CO,完成以下实验装置图:______
中的CO,完成以下实验装置图:______![]() 注:
注:![]() 。
。
(5)CO2在自然界循环时可与![]() 反应,
反应,![]() 是一种难溶物质,其
是一种难溶物质,其![]() 。现将
。现将![]()
![]() 的
的![]() 溶液与一定浓度的
溶液与一定浓度的![]() 溶液等体积混合生成沉淀,计算应加入
溶液等体积混合生成沉淀,计算应加入![]() 溶液的最小浓度为 ______(保留二位有效数字)。
溶液的最小浓度为 ______(保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1 mol·L1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×109]
A. 若将溶液不断加水稀释,则水的电离程度增大
B. 溶液中各离子浓度大小关系:c(Na+)> c(C2O42)> c(OH)> c(H+)> c(HC2O4)
C. 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=105
D. 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×108 mol·L1 时即能产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10g碳酸钙高温加热一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
A.生成了2g二氧化碳B.剩余固体质量为5g
C.生成了5.6g氧化钙D.剩余碳酸钙的质量为8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

(1)氢氧燃料电池的能量转化主要形式是___,在导线中电子流动方向为___(用a、b和箭头表示)。
(2)正极反应的电极反应方程式为___。
(3)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

①图1中N型半导体为___(填“正极”或“负极”)
②该系统工作时,A极的电极反应式为___。
③若A极产生7.00gN2,则此时B极产生___LH2(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com