
【题目】吗啡是严格查禁的毒品.吗啡分子含C71.58%,H6.67%,N4.91%,其余为O.已知其相对分子质量不超过300,则吗啡的分子式是
A.C17H19NO3B.C17H20N2OC.C18H19NO3D.C18H20N2O2
【答案】A
【解析】
可通过假设相对分子质量为100,然后得出碳、氢、氮、氧等元素的质量,然后求出原子个数,然后乘以3,得出的数值即为分子式中原子个数的最大值,进而求出分子式。
假设吗啡的相对分子质量为100,则碳元素的质量就为71.58,碳的原子个数为:![]() =5.965,则相对分子质量如果为300的话,就为5.965×3═17.895;
=5.965,则相对分子质量如果为300的话,就为5.965×3═17.895;
同理,氢的原子个数为:![]() ×3=20.01,氮的原子个数为:
×3=20.01,氮的原子个数为:![]() ×3=1.502,氧的原子个数
×3=1.502,氧的原子个数
为:![]() ×3=3.15,因为吗啡的相对分子质量不超过300,故吗啡的化学式中碳的原子个数不超过17.895,氢的原子个数不超过20.01,氮的原子个数不超过1.502;
×3=3.15,因为吗啡的相对分子质量不超过300,故吗啡的化学式中碳的原子个数不超过17.895,氢的原子个数不超过20.01,氮的原子个数不超过1.502;
符合要求的为A,
答案选A。


科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
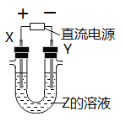
A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.海水提镁中,X、Y均为石墨,Z为MgCl2溶液
D.电镀工业中,X是镀层金属,Y是待镀金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的说法或描述正确的是
A.硫磺矿制备硫酸经历两步:S![]()
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少![]() 排放,发生的反应为:
排放,发生的反应为:![]()
![]()
D.土壤中的闪锌矿![]() 遇到硫酸铜溶液转化为铜蓝
遇到硫酸铜溶液转化为铜蓝![]() ,说明CuS很稳定,不具有还原性
,说明CuS很稳定,不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
B.室温下,将![]() HA溶液和
HA溶液和![]() 溶液等体积混合
溶液等体积混合![]() 忽略体积的变化
忽略体积的变化![]() 测得混合溶液的
测得混合溶液的![]() ,则混合溶液中由水电离出的
,则混合溶液中由水电离出的![]()
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于![]() 时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]()
![]() 的
的![]() 溶液和
溶液和![]()
![]()
![]() 溶液混合后会有
溶液混合后会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫酰![]() 主要用作氯化剂.它是一种无色液体,熔点
主要用作氯化剂.它是一种无色液体,熔点![]() ,沸点
,沸点![]() ,遇水生成硫酸和氯化氢.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
,遇水生成硫酸和氯化氢.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:![]()
(1)为了提高上述反应中![]() 的平衡转化率,下列措施合理的是 ______
的平衡转化率,下列措施合理的是 ______ ![]() 用编号填空
用编号填空![]() .
.
A.缩小容器体积![]() 使用催化剂
使用催化剂![]() 增加
增加![]() 浓度
浓度![]() 升高温度
升高温度
(2)![]() 时,体积为1L的密闭容器中充入
时,体积为1L的密闭容器中充入![]()
![]() ,达到平衡时容器中含
,达到平衡时容器中含![]()
![]() ,则
,则![]() 时合成
时合成![]() 反应的平衡常数为 ______ .
反应的平衡常数为 ______ .
(3)已知某温度下,已知![]() ,
,![]() ,在
,在![]() 溶于水所得溶液中逐滴加入
溶于水所得溶液中逐滴加入![]() 稀溶液,当
稀溶液,当![]() 浓度为
浓度为![]() 时,浑浊液中
时,浑浊液中![]() 浓度与
浓度与![]() 浓度之比为 ______ .
浓度之比为 ______ .
(4)将(2)所得的平衡混合气溶于足量的![]() 溶液中,计算最终生成沉淀的质量是多少
溶液中,计算最终生成沉淀的质量是多少![]() 写出计算过程
写出计算过程![]() .______ .
.______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______________________(任写一种)。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_____________,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为_____________mol/L。
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____________________。
(4)“赶氨”时,最适宜的操作方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取大理石和稀盐酸反应后的废液50g,逐滴加入碳酸钠溶液,根据实验测得的数据绘出右图,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量。下列说法正确的是
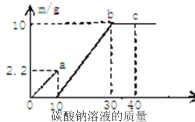
A.图中oa段表示生成的沉淀量
B.c点表示碳酸钠恰好完全反应
C.废液中盐酸的质量分数是7.3%
D.废液中含氯化钙0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水溶液的一些叙述正确的是( )
A.某水溶液中,c(H+)=![]() mol/L,该溶液呈中性
mol/L,该溶液呈中性
B.已知电离常数H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11,HClO的Ka=2.95×10-8,相同温度相同浓度溶液的pH:Na2CO3<NaClO
C.常温下,向Na2S溶液中加入NaCl溶液,S2-的水解程度不受影响
D.向含有Cl-、Br-、I-的混合溶液中滴加AgNO3溶液,先产生黄色沉淀,说明c(I-)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式___________。

(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应I:2NO(g)![]() N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:N2O2(g)+O2(g)![]() 2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
①一定条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
反应I的活化能EI___________反应Ⅱ的活化能EII(填“>”、“<”、或“=”)。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数___________k2逆增大的倍数(填“大于”、“小于”、或“等于”)。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

①装置中H+向___________池迁移。
②乙池溶液中发生反应的离子方程式:______________________。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com