
【题目】铊(81Tl)是某超导材料的组成元素之一,下列有关叙述正确的是( )
A.Tl位于第五周期第IIIA族
B.离子半径:Cs+>Tl3+
C.![]() Tl和
Tl和![]() Tl互为同素异形体
Tl互为同素异形体
D.碱性:Al(OH)3>Tl(OH)3
【答案】B
【解析】
A.0族元素中,原子序数从上到下依次为:2He、10Ne、18Ar、36Kr、54Xe、86Rn,由此族向前推可知,81Tl位于周期表中第六周期第IIIA族,A错误;
B.根据碱金属从上到下排布规律可知,55Cs位于第六周期的IA族元素,81Tl也是位于第六周期的IIIA族元素,Cs+和Tl3+电子层数相同,核电荷数越大,离子半径越小,核电荷数:Cs+<Tl3+,所以离子半径:Cs+>Tl3+,B正确;
C.![]() Tl和
Tl和![]() Tl质子数相同,中子数不同,为Tl元素的两种不同原子,互为同位素,C错误;
Tl质子数相同,中子数不同,为Tl元素的两种不同原子,互为同位素,C错误;
D.Al位于第三周期第IIIA族,即Al和Tl为同主族元素,金属性:Al<Tl,所以碱性:Al(OH)3<Tl(OH)3,D错误。
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图所示。下列有关白屈菜酸的说法中不正确的是( )

A.白屈菜酸的同分异构体中可能含有芳香族化合物
B.所有碳原子可以共面
C.1mol白屈菜酸完全燃烧需要O2的物质的量为4mol
D.能通过加聚反应形成高分子物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
![]()
(1)A的氢化物分子式为___________。
(2)B的元素符号为_________,原子结构示意图为______,在周期表中位于第_______周期_______族;
(3)C的单质分子式为___________,C的单质溶于水所得溶液叫____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:

请回答下列问题:
(1)A的化学名称为__;C中官能团的名称是___。
(2)③的反应试剂和反应条件分别是__,该反应类型是__。
(3)T(C7H7NO2)是E在碱性条件下的水解产物的酸化产物,同时符合下列条件的T的同分异构体有__种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为__。
①—NH2直接连在苯环上②能与新制氢氧化铜悬浊液共热产生红色固体
(4)参照上述合成路线,以CH3CH2COCl和![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]() 的路线为__(其他无机试剂任)。
的路线为__(其他无机试剂任)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右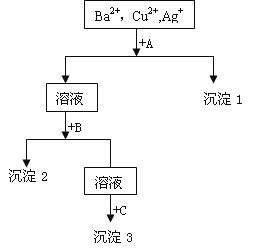
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平衡体系mA(g)+nB(g)![]() pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
A.②④B.②③C.①④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国秋冬季雾霾天气呈现常态化趋势,造成严重空气污染,对人类身心健康造成极大威胁。硫酸盐气溶胶作为PM2.5的主要构成成分,是雾霾产生的一个重要元凶。科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制。如图所示:
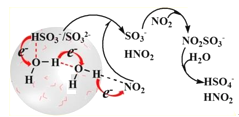
(1)NO2和SO2作为大气初期污染物的主要成分,主要来自_____。
(2)电子传递可以促进HSO![]() 中O—H键的解离,进而形成中间体SO
中O—H键的解离,进而形成中间体SO![]() ,反应的离子方程式为_____。
,反应的离子方程式为_____。
(3)通过“水分子桥”,处于纳米液滴中的SO![]() 或HSO
或HSO![]() 可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠____形成。写出HSO
可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠____形成。写出HSO![]() 与NO2间发生的总反应的离子方程式:_____。
与NO2间发生的总反应的离子方程式:_____。
(4)亚硝酸(HNO2)是一种弱酸,酸性比醋酸稍强,极不稳定,只能存在于稀的水溶液中,加热时发生歧化反应,生成一种强酸和一种遇空气变为红棕色的气体,写出该反应的化学方程式:_____。
(5)结合题中信息,请写出一种鉴别NaNO2和NaCl的方法:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法测量某工业废气中CO的浓度,工作原理如图所示。下列说法不正确的是
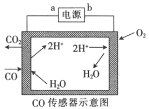
A.b为电源的负极B.阳极的电极反应式为CO+H2O-2e-=CO2+2H+
C.H+向阴极移动D.理论上每消耗11.2 L O2,转移2mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com