
【题目】短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
![]()
(1)A的氢化物分子式为___________。
(2)B的元素符号为_________,原子结构示意图为______,在周期表中位于第_______周期_______族;
(3)C的单质分子式为___________,C的单质溶于水所得溶液叫____________。
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.氢离子的数目减少
B.溶液中![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定CuSO4·xH2O 晶体的x值,数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( )
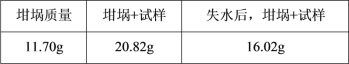
A.晶体中含不挥发杂质B.未做恒重操作
C.加热前晶体未研磨D.加热时有晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空,5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程。如图:
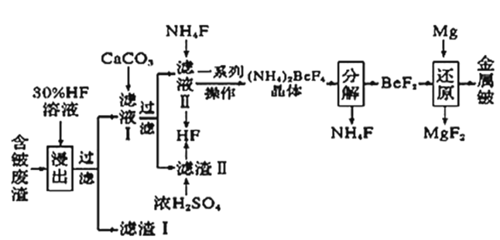
已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有___、__(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:__。
(2)该流程中可循环利用的物质是__;滤渣Ⅱ与浓硫酸发生反应的化学方程式为___;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指__过滤、洗涤、干燥。
(3)“分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为___;“还原”过程可以用金属镁制备金属铍的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molNaHSO4固体中含有离子总数为3NA
B.11.2L(标准状况)HF含有质子数为5NA
C.50g46%的乙醇水溶液中,含有O—H键数为3.5NA
D.1molCu与足量的硫蒸气反应,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】门捷列夫发现化学元素的周期性,依照原子量,制作出世界上第一张元素周期表,并据以预见了一些尚未发现的元素。
完成下列填空:

(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。___
(2)在上表标出的①一⑦号元素中,可以形成化合物种类最多的是___(请填写元素符号,下同),通常情况下不易与其他物质发生反应的是___。
(3)元素1与元素2金属性较强的是___(填元素符号),请解释理由__。
(4)下列事实可以用来判断元素5与6的非金属性强弱的是____。(填序号)
A.两种元素气态氢化物的沸点高低
B.两种元素形成的化合物中元素5显正价
C.两种元素最高价氧化物对应水化物的酸性强弱
D.元素6单质能将元素5从它的氢化物中置换出来
(5)锡(Sn)是很早便被发现和使用的金属,其原子结构示意图见图。

请在上表相应位置填入锡的元素符号。___。
(6)SnO2能与NaOH反应生成钠盐,写出反应的化学方程式___,这个反应可以说明锡元素具有____(填“金属性”或“非金属性”)。锡溶于盐酸得到溶液A,向A中通入氯气,氯气被还原。写出在A中反应的化学方程式____。
(7)解释表中卤化锡的熔、沸点的变化规律___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊(81Tl)是某超导材料的组成元素之一,下列有关叙述正确的是( )
A.Tl位于第五周期第IIIA族
B.离子半径:Cs+>Tl3+
C.![]() Tl和
Tl和![]() Tl互为同素异形体
Tl互为同素异形体
D.碱性:Al(OH)3>Tl(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
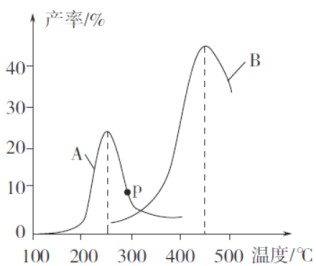
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com