
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中________________________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_________________________________________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的____(填字母)连接在装置______之前(填“甲”或“乙”或“丙”或“丁”)。
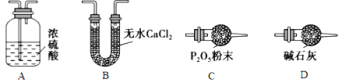
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
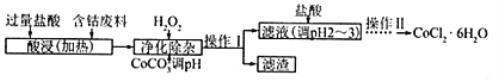
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂质时,加入H2O2发生反应的离子方程式为__________________________________。
②加入CoCO3调pH除杂得到滤渣Al(OH)3、Fe(OH)3,则pH应调节至_____。(填pH值的范围)
③加盐酸调整pH为2~3的目的为_____________________________________。
④操作Ⅱ过程为_________________________________(填操作名称)、过滤。
【答案】不再有气泡产生时 将装置中产生的CO2和H2O(g)全部排入乙、丙装置中 D 甲 Co3(OH)4(CO3)2 2Fe2++H2O2+2H+=2Fe3++2H2O 5.2~7.6 抑制CoCl2的水解 蒸发浓缩、冷却结晶
【解析】
(1)加热甲中玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕;
(2)步骤④中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果;
(3)在活塞a前,加装装置D,装置中盛放的碱石灰容易吸收空气中的水蒸气和二氧化碳;
(4)向含钴废料中加入过量稀盐酸,Fe、Al和稀盐酸反应生成FeCl2、AlCl3、CoCl2,向溶液中加入双氧水和CoCO3,双氧水具有强氧化性,能将亚铁离子氧化为铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,加入CoCO3,调节溶液的pH至7.6,使Fe(OH)3、Al(OH)3生成沉淀,然后过滤,滤渣为Fe(OH)3、Al(OH)3,滤液中含有CoCl2,然后向滤液中加入稀盐酸,抑制CoCl2水解,然后采用蒸发浓缩、冷却结晶和过滤方法得到CoCl26H2O;
①双氧水具有氧化性,能氧化还原性离子;
②加入CoCO3调pH为5.27.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3;
③CoCl2为强酸弱碱盐,阳离子水解导致溶液呈酸性,加入稀盐酸能抑制水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤。
(1)③加热甲中玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕;
故答案为:不再有气泡产生时;
(2)步骤④中缓缓通入空气数分钟,将装置中生成的![]() 和
和![]() 全部排入乙、丙装置中,以免影响测量结果;
全部排入乙、丙装置中,以免影响测量结果;
故答案为:将装置中产生的![]() 和
和![]() (g)全部排入乙、丙装置中;
(g)全部排入乙、丙装置中;
(3)在活塞a前,加装装置D,装置中盛放的碱石灰吸收空气中的水蒸气和二氧化碳,以免影响实验结果;
故答案为:D;甲;
(4)碱式碳酸钴样品3.65g,反应前乙装置的质量为80.00g,反应后质量为80.36g,故生成水的质量为0.36g,物质的量为0.02mol;反应前丙装置的质量为62.00g,反应后质量为62.88g,生成二氧化碳的质量为0.88g,物质的量为0.02mol;故Co的质量为![]() ,故Co原子物质的量为:
,故Co原子物质的量为:
![]() ,根据Co、H、C元素守恒可知,
,根据Co、H、C元素守恒可知,![]() ,故化学式为
,故化学式为![]() ;
;
故答案为:![]() ;
;
(5) ①三价铁离子易转化为沉淀,所以要加入氧化剂过氧化氢把二价铁离子氧化为三价铁离子,而不会引入新的杂质,反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
②根据沉淀的pH值表格知,当溶液的pH值为5.2时,铁离子和铝离子被完全沉淀,当溶液的pH值为7.6时,钴离子才开始产生沉淀,所以要想将铁离子、铝离子和钴离子分离,溶液的pH值应该不小于5.2不大于7.6;
故答案为:5.2~7.6;
③加盐酸调整pH为23的目的为抑制![]() 的水解;
的水解;
故答案为:抑制![]() 的水解;
的水解;
④操作Ⅱ过程为的溶质结晶的过程,利用蒸发浓缩、冷却结晶、过滤得到,
故答案为:蒸发浓缩、冷却结晶。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】11.9g金属锡(Sn)跟100mL12mol·L-1 HNO3共热一段时间。完全反应后测定溶液中c(H+)为8 mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是( )
A.SnO2·4H2OB.Sn(NO3)4
C.Sn(NO3)2D.Sn(NO3)2和Sn(NO3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.12.4 g白磷(P4)中所含的P-P键数目为0.6 NA
B.40 g SiC晶体中含有SiC分子的数目为NA个
C.1 mol麦芽糖完全水解后产生的葡萄糖分子数目为NA
D.标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界。________
(2)表中最活泼的金属与最活泼的非金属形成的物质是________(填化学式)。
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_______,这两种化合物中所含的化学键有______(填字母)。
A.极性共价键 B.非极性共价键 C.离子键
(4) e、f、k、m对应的单原子离子的半径由大到小的顺序为____________(填离子符号)。
(5) d、m对应的离子还原性由强到弱顺序为__________(填离子符号)。
(6) d、e、m的气态氢化物中,最不稳定的是__________(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知p(A)=-lg c(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
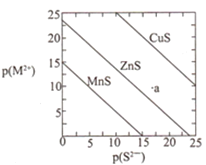
A.a点无ZnS沉淀生成
B.可用MnS除去MnCl2溶液中混有的少量ZnCl2
C.CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=10-20
D.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的结构和性质说法,正确的是( )
A.苯是无色无味的液态径,不易燃烧
B.苯与浓硝酸、浓硫酸混合共热可制取硝基苯
C.溴水能与苯发生加成反应而褪色
D.在一定条件下苯与氢气反应制取环己烷,说明苯分子结构中有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如右图所示。下列叙述正确的是
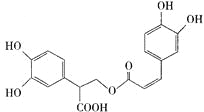
A.迷迭香酸的分子式为C18H15O8
B.迷迭香酸可以发生加成、取代、消去、显色反应
C.1mol迷迭香酸跟H2反应,最多消耗8mol H2
D.1mol迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。

已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是
A. 曲线m表示pH与lg![]() 的变化关系
的变化关系
B. 当溶液呈中性时,c(Na+)=![]() +2
+2![]()
C. Ka1(H2CO3)=1.0×10-6.4
D. 25℃时,CO32-+H2O![]()
![]() +OH-的平衡常数为1.0×10-7.6
+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)常温下,将m mol·L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合后,溶液的pH=7,则m与n的大小关系是m____n(填“>”、“<”或“=”,下同),原酸中c(H+)与碱中c(OH-)的大小关系是c(H+)____c(OH-)。
(2)常温下,将浓度均为0.1mol·L-1的CH3COONa、CH3COOH溶液等体积混合后,溶液呈酸性。则混合溶液中各离子浓度由大到小排序为_____。关于该混合溶液的说法不正确的是___(填代号)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
b.此溶液一定有c(Na+)=c(CH3COOH)+c(CH3COO-)
c.此溶液中水的电离程度一定大于纯水的电离程度
d.向此溶液中加少量氢氧化钠或盐酸,溶液pH变化不大
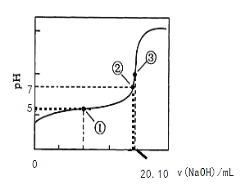
(3)用0.1000 mol·L-1NaOH溶液滴定20.00mL某浓度的CH3COOH溶液,滴定曲线如右图所示。其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。列式并计算醋酸的电离常数_____,CH3COOH的物质的量浓度为____ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com