
【题目】在强酸性无色透明的溶液中,可以大量共存的离子组是
A. K+、NO3ˉ、OHˉ、Clˉ B. SO42-、Al3+、NH4+、Na+
C. Iˉ、Ba2+、Mg2+、NO3ˉ D. Clˉ、SCNˉ、K+、Fe3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
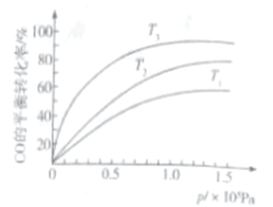
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素在地壳中的含量丰富。关于铁及其化合物的说法错误的是
A. 钢属于铁合金 B. Fe2O3常用作红色油漆的原料
C. Fe(OH)3易溶于水 D. Fe3O4是具有磁性的黑色晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、1.01×105Pa下,将33gCO2通入到1000ml1.0mol·L-1的NaOH溶液中充分反应,放出xkJ热量。在该条件下1molCO2通入到2L1.0mol·L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为
A. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJmol-1
B. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJmol-1
C. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-1/2(4x-y)kJmol-1
D. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(8x-2y)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别代表NaCl、金刚石、干冰、石墨结构的一部分。下列说法正确的是( )
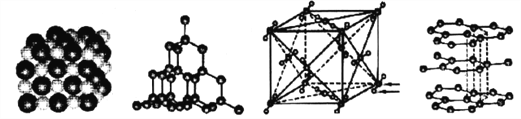
A. NaCl晶体只有在熔融状态下离子键被完全破坏,才能形成自由移动的离子
B. 金刚石中存在的化学键只有共价键,不能导电
C. 干冰中的化学键只需吸收很少的热量就可以破坏,所以干冰容易升华
D. 石墨中碳原子的最外层电子都参与了共价键的形成,故熔点很高、硬度很大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是_________。(用序号表示,下同)
II.常温下,有浓度均为1 mol·L-1的下列四种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)溶液pH由大到小的顺序是 ,其中由水电离的H+浓度最小的是 。(均填序号)
(2)③中各离子浓度由大到小的顺序是_____________ ,升高温度,NH4Cl溶液的pH______(填“升高”、“降低”或“不变”)
(3)向③中通入少量氨气,此时![]() 的值_________(填“增大”、“减小”或“不变”)。
的值_________(填“增大”、“减小”或“不变”)。
(4)将③和④混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用子炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=akJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=bkJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________。
(2)将CO2转化为甲醇的热化学方程式为: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。
①下列情况能说明反应已达平衡状态的是________(填字母)。
A.容器内气体密度不变 B.容器内气体总压强保持不变
C.绝热恒容时,平衡常数不变 D.v正(CH3OH)=3v逆(H2)
②反应过程中测得甲醇的体积分数α(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH______0(填“>”、“<”或“=”)。
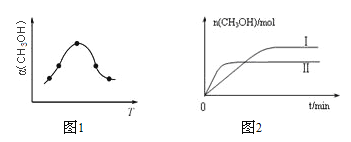
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
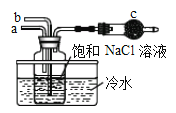
①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在_____处通入NH3气体,然后再在_______处通入CO2气体。
②人工光合作用能够借助太阳能用CO2和水制备化学原料,右图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:________________。
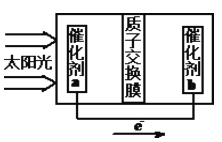
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系说法正确的是( )
A.胶体与溶液本质区别是有无丁达尔效应
B.均一稳定的分散系只有溶液
C.只有胶状物质如胶水、果冻才能称为胶体
D.一束平行光线照射Fe(OH)3胶体时,从侧面可以看到一条光亮通路
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com