
【题目】在25℃、1.01×105Pa下,将33gCO2通入到1000ml1.0mol·L-1的NaOH溶液中充分反应,放出xkJ热量。在该条件下1molCO2通入到2L1.0mol·L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为
A. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJmol-1
B. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJmol-1
C. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-1/2(4x-y)kJmol-1
D. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(8x-2y)kJmol-1
【答案】C
【解析】根据题意,33gCO2通入1molL-1NaOH溶液750mL中充分反应,n(CO2)=![]() =0.75mol,n(NaOH)=1molL-1×1.0L=1mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为3CO2+4NaOH═2NaHCO3+Na2CO3+H2O,由0.75molCO2反应放出热量为xKJ,则3molCO2反应放出热量为4xKJ,即热化学反应方程式为3CO2(g)+4NaOH(aq)═2NaHCO3(aq)+Na2CO3(aq)+H2O(l)△H=-4xKJ/mol①,又1molCO2通入1molL-1NaOH溶液2L中充分反应放出ykJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,由盖斯定律可知,①-②可得,2NaOH(aq)+2CO2(g)═2NaHCO3(aq)△H=-(4x-y)KJ/mol,因此CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-1/2(4x-y)kJmol-1,故选C。
=0.75mol,n(NaOH)=1molL-1×1.0L=1mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为3CO2+4NaOH═2NaHCO3+Na2CO3+H2O,由0.75molCO2反应放出热量为xKJ,则3molCO2反应放出热量为4xKJ,即热化学反应方程式为3CO2(g)+4NaOH(aq)═2NaHCO3(aq)+Na2CO3(aq)+H2O(l)△H=-4xKJ/mol①,又1molCO2通入1molL-1NaOH溶液2L中充分反应放出ykJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,由盖斯定律可知,①-②可得,2NaOH(aq)+2CO2(g)═2NaHCO3(aq)△H=-(4x-y)KJ/mol,因此CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-1/2(4x-y)kJmol-1,故选C。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】4-氨基-3硝基苯甲醚是合成类风湿关节炎治疗药物艾拉莫德的主要原料。4-氨基-3-硝基苯甲醚的合成路线如下:
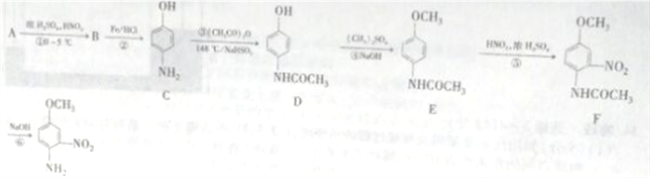
已知: NH2(有弱碱性,易被氧化)
NH2(有弱碱性,易被氧化)
回答下列问题:
(1)A的结构简式为_______________,B的名称是_______________。
(2)反应②的反应类型是____________。
(3)C中官能团的名称是_________________。
(4)写出反应③的化学方程式:________________,反应③温度较高,若不加NaHSO3会导致反应混合体系的颜色明显不同,可能的原因是________________。
(5)写出反应⑥的化学方程式:______________________。
(6)H是E的同分异构体,则满足下列条件的结构有____种(不考虑立体异构),其中核磁共振氢谱中有4组峰,且峰面积比为1:2:2:6的结构简式为_____________。
①含有 结构且能发生银镜反应
结构且能发生银镜反应
②N原子直接与苯环相连,且结构中不存在N—O键;
③苯环上有两个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某组同学为探究草酸浓度对该反应速率的影响,设计下列对照实验:
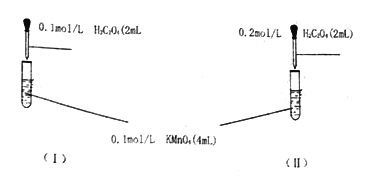
(1)写出上述反应的离子方程式____________。
(2)根据所学知识,你预期的实验现象是:_______(填“l”或“Ⅱ”)中紫色先褪去
(3)实验时,他们发现反应速率的变化从开始后的一段时间内,变化趋势如图,已知反应过程中温度基本不变,分析:
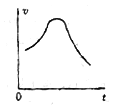
① 反应开始时,速度加块的原因为________;
② 后期反应速度下降的原因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Mg (OH)2和Al(OH)3是工业上常用的阻燃剂,Mg(OH)2的分解温度范围为340~490℃,氢氧化铝的分解温度范围为190~230℃,它们的热化学方程式分别为:
Mg(OH)2(s)=MgO(s)+H2O(g) ΔH1=+81.5kJ·mol-1
Al(OH)3(s)=![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g) ΔH2=+87.7kJ·mol-1下列说法不正确的是
H2O(g) ΔH2=+87.7kJ·mol-1下列说法不正确的是
A. Mg(OH)2和Al(OH)3高温下不分解,所以可做工业阻燃剂
B. 等质量Mg(OH)2和Al(OH)3相比, Mg(OH)2阻燃效果较好
C. Mg(OH)2比Al(OH)3热稳定性高
D. Mg(OH)2和Al(OH)3作为工业阻燃剂与它们分解吸热及生成物具有耐高温性有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述的说法不正确的是
A.金属的电化学腐蚀比化学腐蚀更普遍
B.用牺牲锌块的方法来保护船身
C.用铝质铆钉铆接铁板,铁板易被腐蚀
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如图所示
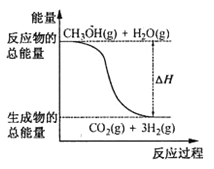
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明的溶液中,可以大量共存的离子组是
A. K+、NO3ˉ、OHˉ、Clˉ B. SO42-、Al3+、NH4+、Na+
C. Iˉ、Ba2+、Mg2+、NO3ˉ D. Clˉ、SCNˉ、K+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Cr2(SO4)3的水溶液中加入Na0H溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-),其平衡关系为:![]()
向50mL0.05mol/L的Cr2(SO4)3溶液中,加入l.0mol/L的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
A. 溶液为紫色 B. 溶液中有灰绿色沉淀 C. 溶液为亮绿色 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语
回答下列问题:
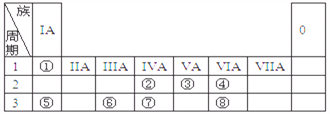
(1)画出⑦的原子结构示意图_______;
(2)②⑤⑥的原子半径由大到小的顺序为_______(填元素符号);②⑦⑧的最高价含氧酸的酸性由强到弱的顺序是_______(填化学式);
(3)②与④的一种化合物是温室气体的主要成分,该物质的结构式为_____________;
(4)①③④⑧四种元素形成的一种化合物既含离子键又含共价键,还可以用作化肥,
该物质的化学式为___________。
(5)⑤⑥⑧的最高价氧化物的水化物之间可以相互反应,请写出⑤⑥两元素最高价氧化物的水化物之间发生反应的离子方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com