
| -2-(-2)×7 |
| 2 |


科目:高中化学 来源: 题型:
| 试剂 | 保存方法 | 理由 | |
| A | 浓硫酸 | 保存在密闭的细口瓶中 | 浓硫酸容易吸收空气中的水分 |
| B | 白磷 | 保存在水中 | 白磷在空气中易自燃 |
| C | 浓盐酸 | 保存在密闭的细口瓶中 | 浓盐酸易挥发 |
| D | 固体氢氧化钠 | 保存在带橡皮塞的细口瓶中 | 防止与空气接触氧化 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.6g Na 4.8g Mg |
| B、5g Na 5g Al |
| C、2.3g Na 2.4g Mg |
| D、1.8g Al 2.4g Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH 稀盐酸 |
| B、NaCL溶液、K2CO3溶液 |
| C、K2CO3溶液 澄清石灰水 |
| D、Ca(NO3)2溶液、K2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸可以导电,所以盐酸是电解质 |
| B、氧化还原反应中都只有一种元素化合价升高 |
| C、纳米材料也是一种胶体 |
| D、丁达尔效应,是胶体粒子对光散射形成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L |
| B、0.2 mol/L |
| C、0.3 mol/L |
| D、0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、直径介于1nm~100nm之间的微粒称为胶体 |
| B、胶体加入电解质可产生沉淀,而溶液不能 |
| C、可用渗析法分离Fe(OH)3胶体和FeCl3溶液的混合物 |
| D、胶体区别于其它分散系的本质特性是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
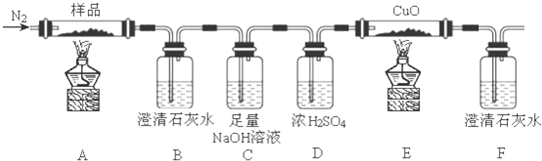
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com