
【题目】写出下列盐类水解的离子方程式,并指出其溶液的酸碱性.
(1)硫酸铝溶液:(显性).
(2)硝酸铵溶液:(显_性).
(3)次氯酸钠溶液:(显性).
(4)碳酸氢钠溶液:(显性).
【答案】
(1)Al3++3H2O?Al(OH)3+3H+;酸
(2)NH ![]() +H2O?NH3?H2O+H+;酸
+H2O?NH3?H2O+H+;酸
(3)ClO﹣+H2O?HlCO+OH﹣;碱
(4)HCO ![]() +H2O?H2CO3+OH﹣;碱
+H2O?H2CO3+OH﹣;碱
【解析】解:(1)硫酸铝强酸弱碱盐,水解显酸性,铝离子水解生成氢氧化铝和氢离子,水解离子方程式:Al3++3H2OAl(OH)3+3H+;溶液显酸性;所以答案是:Al3++3H2OAl(OH)3+3H+;酸性;(2)硝酸铵强酸弱碱盐,水解显酸性,铵根离子水解生成一水合氨和氢离子,水解离子方程式:NH ![]() +H2ONH3H2O+H+ , 溶液呈酸性;所以答案是:NH
+H2ONH3H2O+H+ , 溶液呈酸性;所以答案是:NH ![]() +H2ONH3H2O+H+ , 酸性;(3)次氯酸钠强碱弱酸盐,水解显碱性,次氯酸根离子水解生成次氯酸和氢氧根离子,水解离子方程式:ClO﹣+H2OHlCO+OH﹣ , 溶液呈碱性;所以答案是:ClO﹣+H2OHlCO+OH﹣ , 碱性;(4)碳酸氢钠为强碱弱酸盐,水解显碱性,碳酸氢根离子水解生成碳酸和氢氧根离子,水解离子方程式:HCO
+H2ONH3H2O+H+ , 酸性;(3)次氯酸钠强碱弱酸盐,水解显碱性,次氯酸根离子水解生成次氯酸和氢氧根离子,水解离子方程式:ClO﹣+H2OHlCO+OH﹣ , 溶液呈碱性;所以答案是:ClO﹣+H2OHlCO+OH﹣ , 碱性;(4)碳酸氢钠为强碱弱酸盐,水解显碱性,碳酸氢根离子水解生成碳酸和氢氧根离子,水解离子方程式:HCO ![]() +H2OH2CO3+OH﹣ , 溶液呈碱性;所以答案是:HCO
+H2OH2CO3+OH﹣ , 溶液呈碱性;所以答案是:HCO ![]() +H2OH2CO3+OH﹣ , 碱性;
+H2OH2CO3+OH﹣ , 碱性;


科目:高中化学 来源: 题型:
【题目】从苯酚的乙醇溶液中回收苯酚有以下8种可供选择的操作,其中合理的操作是( )
①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤通过足量CO2 ⑥加入足量NaOH溶液 ⑦加入乙酸与浓硫酸混合液加热 ⑧加入足量的三氯化铁溶液.
A.④⑤③
B.⑦①
C.①
D.⑥①⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验,验证元素周期律.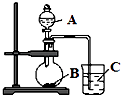
(1)甲同学在a、b、c、d四只烧杯里分别加入50mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象.①甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性;
②反应最剧烈的烧杯里金属是(填字母)
A、钠 B、镁 C、铝 D、钾;
③写出a烧杯里发生反应的离子方程式 .
④实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法 .
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
(2)乙同学设计实验验证:非金属元素的非金属性越强,其最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,其浓溶液在常温下可与铜反应;B是块状固体;烧杯中盛放C的水溶液,打开分液漏斗的活塞后,C中可观察到白色胶状沉淀生成.①写出所选用物质的化学式:A、; C、 .
②写出烧瓶中发生反应的化学方程式: .
③碳、氮、硅三种元素的非金属性由强到弱顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的不可能是( ) 
A.N2与NO2的混和气体
B.O2与NO2的混和气体
C.NO与NO2的混和气体
D.NO2一种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( ) 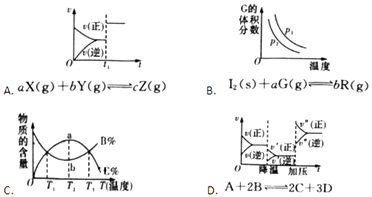
A.t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2
C.从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应
D.反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A,B一定是气体,D一定不是气体,C可能不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2molL﹣1H2C2O4溶液中滴加0.2molL﹣1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4 , Ⅱ代表HC2O ![]() ,Ⅲ代表C2O
,Ⅲ代表C2O ![]() ),根据图示判断,下列说法正确的是( )
),根据图示判断,下列说法正确的是( ) 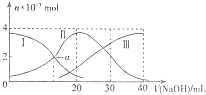
A.H2C2O4在水中的电离方程式是:H2C2O4?2H++C2O ![]()
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水小
C.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+2c(HC2O ![]() )+3c(H2C2O4)═c(C2O
)+3c(H2C2O4)═c(C2O ![]() )+2c(OH﹣)
)+2c(OH﹣)
D.已知H2C2O4的电离常数分别为K1、K2 , 则a点的c(H+)=K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3﹣CH═CH﹣Cl能发生( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
A.以上反应均可发生
B.只有⑥不能发生
C.只有⑦不能发生
D.只有②不能发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com