
【题目】常温下,向20mL0.2molL﹣1H2C2O4溶液中滴加0.2molL﹣1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4 , Ⅱ代表HC2O ![]() ,Ⅲ代表C2O
,Ⅲ代表C2O ![]() ),根据图示判断,下列说法正确的是( )
),根据图示判断,下列说法正确的是( ) 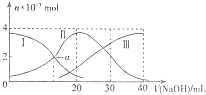
A.H2C2O4在水中的电离方程式是:H2C2O4?2H++C2O ![]()
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水小
C.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+2c(HC2O ![]() )+3c(H2C2O4)═c(C2O
)+3c(H2C2O4)═c(C2O ![]() )+2c(OH﹣)
)+2c(OH﹣)
D.已知H2C2O4的电离常数分别为K1、K2 , 则a点的c(H+)=K2
【答案】B
【解析】解:A、草酸是二元弱酸,分步电离,电离方程式为H2C2O4H++HC2O4﹣ , HC2O ![]() H++C2O
H++C2O ![]() ,故A错误; B、根据图象知,当V(NaOH)=20时,溶液主要为NaHC2O4 , HC2O
,故A错误; B、根据图象知,当V(NaOH)=20时,溶液主要为NaHC2O4 , HC2O ![]() 以电离为主,溶液显酸性,抑制水的电离,故B正确;
以电离为主,溶液显酸性,抑制水的电离,故B正确;
C、当V(NaOH)=30mL时,溶液中的溶质为相同物质的量的Na2C2O4和NaHC2O4的混合物,据物料守恒3c(Na+)=2c(HC2O ![]() )+2c(H2C2O4)+c(H+)+2c(C2O
)+2c(H2C2O4)+c(H+)+2c(C2O ![]() ),据电荷守恒c(H+)+c(Na+)=2c(C2O
),据电荷守恒c(H+)+c(Na+)=2c(C2O ![]() )+c(OH﹣)+c(HC2O
)+c(OH﹣)+c(HC2O ![]() ),所以有4c(H+)+2c(H2C2O4)═4c(C2O
),所以有4c(H+)+2c(H2C2O4)═4c(C2O ![]() )+3c(OH﹣)+c(HC2O
)+3c(OH﹣)+c(HC2O ![]() ),故C错误;
),故C错误;
D、a点时,c(HC2O ![]() )=c(H2C2O4),K1=
)=c(H2C2O4),K1= ![]() ,所以a点的c(H+)=K1 , 故D错误;
,所以a点的c(H+)=K1 , 故D错误;
故选B.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】①~⑩为短周期元素,其常见化合价与原子序数的关系如下图所示。请回答下列问题。
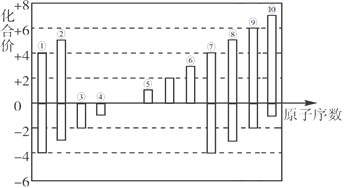
(1)④、⑩的简单离子半径由大到小的顺序为_______(填离子符号)。
(2)由上述元素形成的、稳定性最好的气态氢化物的电子式为_______。
(3)②的简单氢化物与其最高价氧化物的水化物可以发生化合反应,所得产物中包含的化学键类型为_________________。
(4)⑧、⑩的最高价氧化物的水化物的酸性________>________(填化学式)。
(5)写出⑥的单质和⑤的最高价氧化物对应水化物的水溶液之间反应的离子方程式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列盐类水解的离子方程式,并指出其溶液的酸碱性.
(1)硫酸铝溶液:(显性).
(2)硝酸铵溶液:(显_性).
(3)次氯酸钠溶液:(显性).
(4)碳酸氢钠溶液:(显性).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5 , 依次发生的分解反应为①N2O5(g)N2O3(g)+O2(g),②N2O3(g)N2O(g)+O2(g);在2L密闭容器中充入6mol N2O5 , 加热到t℃,达到平衡状态后O2为8mol,N2O3为3.2mol.则t℃时反应①的平衡常数为( )
A.10.7
B.8.5
C.32
D.64
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( ) 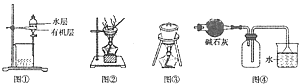
A.图①中是用苯萃取碘水后的有机层和水层
B.用图②所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.在从海带中提取碘的实验中,可用图③装置灼烧海带
D.图④装置常用于收集干燥的NH3 , 若将碱石灰改成P2O5 , 可用于收集干燥的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素性质的递变规律不正确的是( )
A.NaOH,KOH,RbOH的碱性逐渐增强
B.HCl,H2S,PH3的稳定性逐渐减弱
C.Na,K,Rb的原子半径依次增大
D.HF,HCl,HBr,HI的稳定性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果成功制得4个第115号元素的原子。其与N元素同主族.这4个原子在生成数微秒后衰变成第113号元素.前者的一种核素为![]() 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )
A. 115号元素衰变成113号元素是化学变化
B. 115号元素X的近似相对原子质量为288
C. 113号元素的原子最外层有3个电子
D. 因115号元素与N元素同主族,所以是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案(图1和图2)进行实验探究:
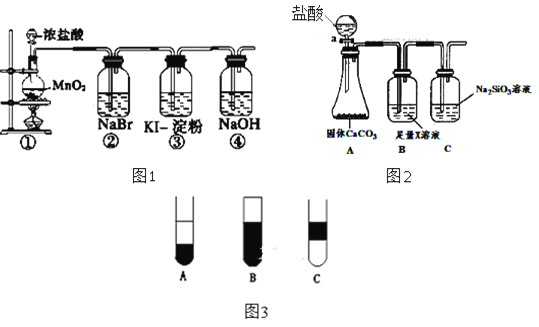
(1)根据方案一装置(图1)回答以下问题:
Ⅰ.写出装置①发生的化学反应方程式:______。
Ⅱ.若将反应后②中的溶液倒入CCl4中,出现的现象与图3吻合的是______。(填字母代号)
Ⅲ.装置③中的现象是______。
(2)根据方案二装置(图2)回答以下问题:
Ⅰ.B装置的作用是______,X是______。
Ⅱ.能说明碳元素和硅元素非金属性强弱的实验现象是______。
(3)实验结论:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质Li,Na,Mg,Al组成的合金粉末)进行探究.请完成下列探究报告.
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2molL﹣1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚).若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+ . 但Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下.请填写下表.
试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
① | 取少量该焰火原料加入冷水 | 无明显现象 | |
② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体产生,溶液呈无色 |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁.乙的结论(选填“正确”或“错误”),你的理由是 .
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下.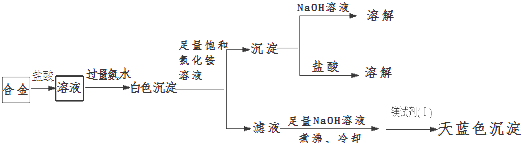
由丙的实验记录可知,该焰火原料是由和两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是 .
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成.
问题讨论:
①能确定合金组成的数据组有(填写选项字母);
A.m、n B.m、y C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线 ;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com