
【题目】下列叙述正确的是( ) 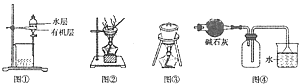
A.图①中是用苯萃取碘水后的有机层和水层
B.用图②所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.在从海带中提取碘的实验中,可用图③装置灼烧海带
D.图④装置常用于收集干燥的NH3 , 若将碱石灰改成P2O5 , 可用于收集干燥的HCl
科目:高中化学 来源: 题型:
【题目】水的离子积常数KW与温度t(℃)的关系如图所示: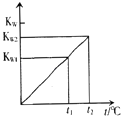
(1)若t1=25℃,则KW1=;若t2=100℃时,KW2=10﹣12 , 则0.05molL﹣1的Ba(OH)2溶液的pH= .
(2)已知25℃时,0.1L0.1molL﹣1的NaA溶液的pH=10,则NaA溶液中所存在的化学平衡有(用离子方程式表示): . 溶液中各离子的物质的量浓度由大到小的顺序为 .
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为 .
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH(pH酸)与强碱的pH(pH碱)之间应满足的关系为:pH(酸)+pH(碱)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验,验证元素周期律.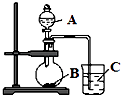
(1)甲同学在a、b、c、d四只烧杯里分别加入50mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象.①甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性;
②反应最剧烈的烧杯里金属是(填字母)
A、钠 B、镁 C、铝 D、钾;
③写出a烧杯里发生反应的离子方程式 .
④实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法 .
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
(2)乙同学设计实验验证:非金属元素的非金属性越强,其最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,其浓溶液在常温下可与铜反应;B是块状固体;烧杯中盛放C的水溶液,打开分液漏斗的活塞后,C中可观察到白色胶状沉淀生成.①写出所选用物质的化学式:A、; C、 .
②写出烧瓶中发生反应的化学方程式: .
③碳、氮、硅三种元素的非金属性由强到弱顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( ) 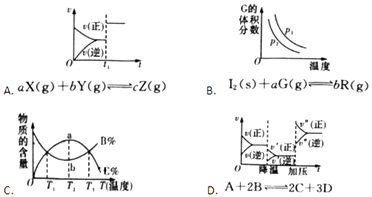
A.t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2
C.从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应
D.反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A,B一定是气体,D一定不是气体,C可能不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组设计以下装置进行不同的实验.其中a为用于鼓入空气的气囊,b为螺旋状铜丝,c中盛有冰水.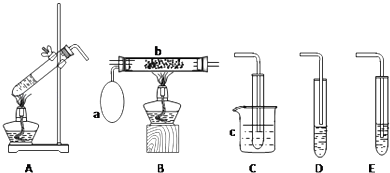
(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是(填序号),该装置中应加入试剂 .
(2)该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是(填序号),再用制得的乙醛进行银镜反应,正确的操作顺序是(填序号).①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管中加入1mL2%的AgNO3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2molL﹣1H2C2O4溶液中滴加0.2molL﹣1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4 , Ⅱ代表HC2O ![]() ,Ⅲ代表C2O
,Ⅲ代表C2O ![]() ),根据图示判断,下列说法正确的是( )
),根据图示判断,下列说法正确的是( ) 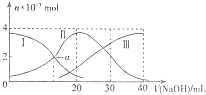
A.H2C2O4在水中的电离方程式是:H2C2O4?2H++C2O ![]()
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水小
C.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+2c(HC2O ![]() )+3c(H2C2O4)═c(C2O
)+3c(H2C2O4)═c(C2O ![]() )+2c(OH﹣)
)+2c(OH﹣)
D.已知H2C2O4的电离常数分别为K1、K2 , 则a点的c(H+)=K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用如图所示的装置来制取氨气。回答下列问题:
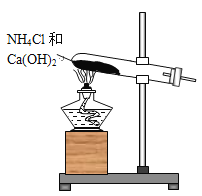
(1)安装仪器时要求试管口略低于试管底的原因是:_____________________________________________。
(2)制取氨气时的化学反应方程式为:___________________________________________。
(3)收集氨气时必须使用干燥的集气装置的原因是________________________。
(4)加热后将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是:____________________________________________________。
(5)除氨气外,还可以用该装置制取的常见气体是 _______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水合硫酸四氨合铜(Ⅱ)[Cu(NH3)4]SO4)H2O为深蓝色晶体,在工业上用途广泛,常用作杀虫剂、媒染剂.某学习小组探究制备该晶体并测定其组成的实验过程如下:(Ⅰ)晶体的制备原理及流程:
CuSO4+4NH3+H2O═[Cu(NH3)4]SO4)H2O
回答下列问题:
(1)无水乙醇的作用;烘干晶体的温度性质60℃的原因是;
(2)实验制得产物晶体中往往有Cu2(OH)2SO4杂质,分析产生该杂质的原因可能是;
(3)(Ⅱ)晶体中溶解于酸性溶液中,加入NaI溶液,Cu2+可与I作用产生I2和白色沉淀,该反应的离子方程式为 , 再用Na2S2O3溶液滴定I2 , 即可得Cu2+含量;
(4)(Ⅲ)晶体中氮含量的测定实验装置如图所示,称取0.9380g[Cu(NH3)x]SO4H2O晶体[M=(178+17x)g/mol]于锥形瓶a中,通过分液漏斗向锥形瓶a中滴加10%NaOH溶液,用1.000mol/L的NaOH标准滴定b中剩余的HCl.
滴定管读数如图所示,消耗标准液mL;[Cu(NH3)x]SO4H2O中x= , 推测测量值(x)比理论值偏小的原因是;
(5)(Ⅳ)SO42﹣含量的测定﹣﹣沉淀法称取一定质量的试样,加稀盐酸溶解,将BaCl2加入溶液中,静置得到BaSO4沉淀,检验沉淀已完全的操作为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于摩尔(mol)的有关说法正确的是
A. 摩尔是一个基本物理量
B. 氧气(O2)的摩尔质量为32g
C. 1mol任何粒子的粒子数为阿伏伽德罗常数
D. 阿伏加德罗常数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com