
【题目】水的离子积常数KW与温度t(℃)的关系如图所示: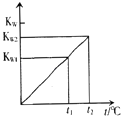
(1)若t1=25℃,则KW1=;若t2=100℃时,KW2=10﹣12 , 则0.05molL﹣1的Ba(OH)2溶液的pH= .
(2)已知25℃时,0.1L0.1molL﹣1的NaA溶液的pH=10,则NaA溶液中所存在的化学平衡有(用离子方程式表示): . 溶液中各离子的物质的量浓度由大到小的顺序为 .
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为 .
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH(pH酸)与强碱的pH(pH碱)之间应满足的关系为:pH(酸)+pH(碱)= .
【答案】
(1)10﹣14;11
(2)A﹣+H2O?HA+OH﹣ , H2O?H++OH﹣;c(Na+)>c(A﹣)>c(OH﹣)>c(H+)
(3)1:9
(4)13
【解析】解:(1)在25℃,则Kw=10﹣14 , 根据pH=﹣lgc(H+)=﹣lg ![]() =11,所以答案是:10﹣14;11;(2)由于0.1L 0.1mo/L的NaA溶液的pH=10,说明溶液显示碱性,属于强碱弱酸盐,存在平衡A﹣+H2OHA+OH﹣ , H2OH++OH﹣ , 故不水解的钠离子浓度大于A﹣离子浓度,溶液显碱性,氢离子浓度大于氢氧根离子浓度,所以答案是:A﹣+H2OHA+OH﹣ , H2OH++OH﹣;c(Na+)>c(A﹣)>c(OH﹣)>c(H+);(3)设氢氧化钠溶液的体积为xL,硫酸溶液的体积为yL,pH=11的NaOH溶液中,氢氧根离子的浓度为:10﹣3mol/L,pH=4的硫酸溶液中氢离子浓度为:10﹣4mol/L,二者混合后溶液的pH=9,溶液酸性碱性,溶液中氢氧根离子的浓度为10﹣5mol/L,即氢氧化钠过量,即10﹣3mol/L×xL﹣10﹣4mol/L×y=10﹣5mol/L(x+y),解得x:y=1:9,所以答案是:1:9;(4)设强酸溶液的pH为a,体积为10V,溶液中氢离子浓度为:10﹣amol/L;碱溶液的pH为b,体积为V,溶液中氢氧根离子的浓度为:10﹣(12﹣b)mol/L,混合后溶液呈中性,则满足溶液中氢离子的物质的量大于氢氧根离子的物质的量,即10﹣amol/L×10VL=10﹣(12﹣b)mol/L×VL,解得:1﹣a=b﹣12,a+b=13,所以答案是:13.
=11,所以答案是:10﹣14;11;(2)由于0.1L 0.1mo/L的NaA溶液的pH=10,说明溶液显示碱性,属于强碱弱酸盐,存在平衡A﹣+H2OHA+OH﹣ , H2OH++OH﹣ , 故不水解的钠离子浓度大于A﹣离子浓度,溶液显碱性,氢离子浓度大于氢氧根离子浓度,所以答案是:A﹣+H2OHA+OH﹣ , H2OH++OH﹣;c(Na+)>c(A﹣)>c(OH﹣)>c(H+);(3)设氢氧化钠溶液的体积为xL,硫酸溶液的体积为yL,pH=11的NaOH溶液中,氢氧根离子的浓度为:10﹣3mol/L,pH=4的硫酸溶液中氢离子浓度为:10﹣4mol/L,二者混合后溶液的pH=9,溶液酸性碱性,溶液中氢氧根离子的浓度为10﹣5mol/L,即氢氧化钠过量,即10﹣3mol/L×xL﹣10﹣4mol/L×y=10﹣5mol/L(x+y),解得x:y=1:9,所以答案是:1:9;(4)设强酸溶液的pH为a,体积为10V,溶液中氢离子浓度为:10﹣amol/L;碱溶液的pH为b,体积为V,溶液中氢氧根离子的浓度为:10﹣(12﹣b)mol/L,混合后溶液呈中性,则满足溶液中氢离子的物质的量大于氢氧根离子的物质的量,即10﹣amol/L×10VL=10﹣(12﹣b)mol/L×VL,解得:1﹣a=b﹣12,a+b=13,所以答案是:13.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( ) 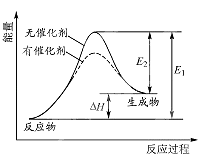
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( ) ①Na+、Fe2+、H+、NO ![]() ②K+、NH
②K+、NH ![]() 、HCO
、HCO ![]() 、OH﹣
、OH﹣
③S2﹣、SO ![]() 、Cl﹣、OH﹣④Fe2+、Fe3+、Cu2+、SO
、Cl﹣、OH﹣④Fe2+、Fe3+、Cu2+、SO ![]()
⑤K+、Na+、AlO ![]() 、HCO
、HCO ![]() ⑥Ca2+、Na+、SO
⑥Ca2+、Na+、SO ![]() 、CO
、CO ![]() .
.
A.①⑥
B.③
C.②⑤
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
(1)Ⅰ.将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应最慢.
(2)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: , .
(3)Ⅱ.利用如图装置可以验证非金属性的变化规律.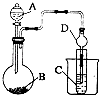
仪器A的名称为 , 干燥管D的作用是 .
(4)实验室中现有药吕Na2S、KMnO4、浓盐酸、MnO2 , 请选择合适药品设计实验验证氯的非金属性大于硫;装置A、B、C中所装药品分别为、、 . 装置C中实验现象为有淡黄色沉淀生成,离子方程式为 .
(5)若要证明非金属性:C>Si,则A中 , B中加Na2CO3、C中加 , 观察到C中溶液的现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑩为短周期元素,其常见化合价与原子序数的关系如下图所示。请回答下列问题。
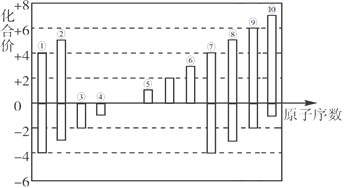
(1)④、⑩的简单离子半径由大到小的顺序为_______(填离子符号)。
(2)由上述元素形成的、稳定性最好的气态氢化物的电子式为_______。
(3)②的简单氢化物与其最高价氧化物的水化物可以发生化合反应,所得产物中包含的化学键类型为_________________。
(4)⑧、⑩的最高价氧化物的水化物的酸性________>________(填化学式)。
(5)写出⑥的单质和⑤的最高价氧化物对应水化物的水溶液之间反应的离子方程式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法正确的是( )
A.在正极上发生氧化反应
B.化学性质较活泼的金属为负极
C.在外电路,电子流出正极
D.是由电能转化为化学能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( ) 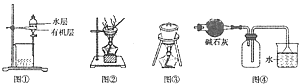
A.图①中是用苯萃取碘水后的有机层和水层
B.用图②所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.在从海带中提取碘的实验中,可用图③装置灼烧海带
D.图④装置常用于收集干燥的NH3 , 若将碱石灰改成P2O5 , 可用于收集干燥的HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com