
【题目】某化学活动小组设计以下装置进行不同的实验.其中a为用于鼓入空气的气囊,b为螺旋状铜丝,c中盛有冰水.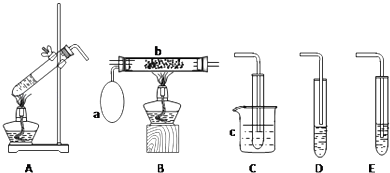
(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是(填序号),该装置中应加入试剂 .
(2)该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是(填序号),再用制得的乙醛进行银镜反应,正确的操作顺序是(填序号).①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管中加入1mL2%的AgNO3溶液.
【答案】
(1)D;饱和Na2CO3溶液
(2)AB;④②①③
【解析】解:(1)若用A装置做乙醇与乙酸的酯化反应实验,需要连接D装置,加入饱和碳酸钠溶液,吸收乙醇,中和乙酸,降低乙酸乙酯溶解度,导管口在液面上防止倒吸,故答案为:D;饱和Na2CO3溶液;碎瓷片/沸石;防暴沸(防止剧烈沸腾);(2)做乙醇氧化成乙醛的实验,需要提供乙醇蒸气和氧气在催化剂作用下氧化反应生成乙醛,反应的化学方程式为2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O,冷却得到液体乙醛,装置连接为A、B、C;乙醛溶液进行银镜反应,先制取银氨溶液,向硝酸银溶液中滴入氨水至变色沉淀全部溶解得到银氨溶液,滴入乙醛溶液在水浴中加热反应观察银镜现象,实验顺序是④②①③, 故答案为:ABC;④②①③.
2CH3CHO+2H2O,冷却得到液体乙醛,装置连接为A、B、C;乙醛溶液进行银镜反应,先制取银氨溶液,向硝酸银溶液中滴入氨水至变色沉淀全部溶解得到银氨溶液,滴入乙醛溶液在水浴中加热反应观察银镜现象,实验顺序是④②①③, 故答案为:ABC;④②①③.
(1)若用A装置做乙醇与乙酸的酯化反应实验,需要连接D装置吸收乙醇,中和乙酸,降低乙酸乙酯溶解度,防止倒吸;(2)做乙醇氧化成乙醛的实验,需要提供乙醇蒸气和氧气在催化剂作用下氧化反应生成乙醛,冷却得到液体乙醛;乙醛溶液进行银镜反应,先制取银氨溶液,向硝酸银溶液中滴入氨水至变色沉淀全部溶解得到银氨溶液,滴入乙醛溶液在水浴中加热反应观察银镜现象.


科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl﹣和Fe3+ .
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是>> .
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 .
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2 , 同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O.①写出第二步反应的离子方程式 .
②工业生产时需在反应物中加少量Cl﹣ , 其作用是 .
③生产中会发生副反应ClO3﹣+Cl﹣+H+﹣Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为 .
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为﹣59℃,沸点为11.0℃,易溶于水.ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2 , 其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置;
②C中应装的试剂为 . C中发生反应的化学方程式为: . 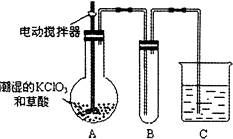
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( ) 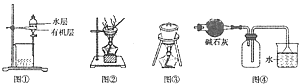
A.图①中是用苯萃取碘水后的有机层和水层
B.用图②所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.在从海带中提取碘的实验中,可用图③装置灼烧海带
D.图④装置常用于收集干燥的NH3 , 若将碱石灰改成P2O5 , 可用于收集干燥的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实写出下列反应的热化学方程式.
(1)1g碳与适量水蒸气反应生成CO和H2 , 需要吸收10.94KJ热量,此反应的热化学方程式为
(2)已知2.0g燃料肼(N2H4)气体完全燃烧生成N2和水蒸气时,放出33.4KJ的热量,则肼燃烧的热化学方程式为
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8KJ的热量.此反应的热化学方程式为
(4)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g液态水和2.24LCO2(标准状况)并放出68.35KJ的热量.写出此反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
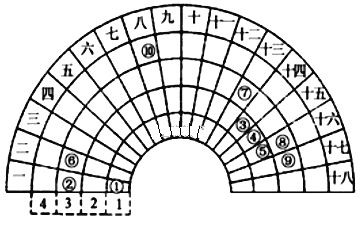
A. ⑥、⑧、⑨对应单核离子的半径依次增大
B. ⑤的三种核素的化学性质不相同
C. ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
D. ⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2SO3HSO ![]() +H+的电离平衡常数Kh=1×10﹣2 , 下列说法不正确的足( )
+H+的电离平衡常数Kh=1×10﹣2 , 下列说法不正确的足( )
A.该温度下NaHSO3 的水解平衡常数Kh=1×10﹣2
B.若向NaHSO3 溶液中加入少量的I2 , 则溶液中 ![]() 将减小
将减小
C.略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大
D.NaHSO3溶液中:c(H+)<c(SO ![]() )+c(HSO
)+c(HSO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com