
【题目】体积为V mL,密度为d g/mL的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol/L,质量分数为w%,下列表达式正确的是( )
A. c=(w×1000×d)/M B. m=V×d×w
C. w%=(c×M)/(1000×d)% D. c=(1000×m)/(V×M)
科目:高中化学 来源: 题型:
【题目】某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取较纯净的NaCl,实验前他们设计了如下图方案。

请回答:
(1)请写出操作第④、⑤步所加试剂名称:④________________⑤________________;
(2)写出第④步操作中可能发生反应的化学方程式:___________;_________________。
(3)如何用最简单方法检验第⑤步实验是否达到了目的:________________________________________;
(4)你认为该设计里哪些步骤调换后不影响实验结果:______________________________;
(5)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A. 2 g H2含有的氢原子数目为NA
B. 1 L 1molL﹣1KOH溶液中含有的钾离子数目为NA
C. 1 mol Zn完全变为Zn2+失去的电子数目为NA
D. 常温常压下,22.4 LO2含有的分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g 时,隔板处于如图位置(保持温度不变),下列说法正确的是
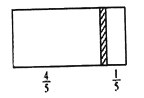
A. 右边CO与CO2分子数之比为1:3
B. 右侧CO的质量为14g
C. 右侧气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为5: 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是
A. 共价化合物可能含有离子键
B. CCl4和NH3都是只含有极性键的共价化合物
C. Na2O2是含有非极性键的离子化合物
D. CaO和NaCl晶体熔化时要破坏离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究(NH4)2 SO4 和 NH4HSO4混合物样品组成,称取四份该样品分别逐滴加入相同 浓度的 NaOH 溶液 40.0 mL,加热并完全反应,产生 NH3的体积(已折算成标准状况,
不考虑NH3在水中的溶解)如下表:
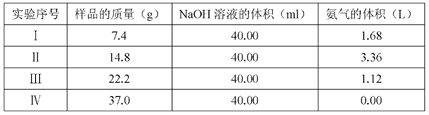
(1)样品中(NH4)2 SO4和NH4HSO4的物质的量之比为_____________。
(2)NaOH 溶液的物质的量浓度为_________________________(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基烯酸酯在碱性条件下能快速聚合为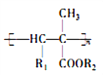 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
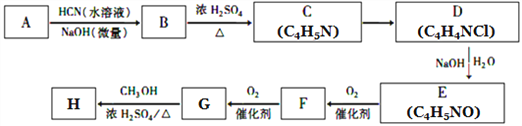
已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;
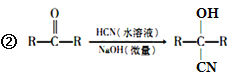
回答下列问题:
(1)A的化学名称为____________。
(2)C的结构简式为________________,F中的含氧官能团名称是________________。
(3)由E生成F的反应类型为_____________,由G生成H的反应类型为_____________。
(4)由G生成H的化学方程式为________________________________。
(5)写出A的能够发生银镜反应的同分异构体的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,1体积水中能溶解500体积的HCl气体。若向水中通入标准状况下的44.8 L HCl气体配成1 L溶液,假设气体完全溶解,所得溶液中含HCl的物质的量浓度为____________,若得溶液密度为1.0g/cm3,则溶液中含HCl质量分数为________;从该溶液中取出10 mL浓盐酸溶解于水配制成250 mL溶液,配制后的稀溶液中含HCl物质的量浓度为________。在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有________________;配制过程中,造成浓度偏低的操作可能有________________(选填下列操作的序号)。
A.容量瓶用蒸馏水洗后未加干燥
B.量筒用蒸馏水洗后未干燥
C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量瓶中加水到刻度
D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线
E.定容时,俯视液面加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com