
【题目】如图是甲醇燃料电池结构示意图,甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2→2CO2+4H2O。下列说法正确的是( )
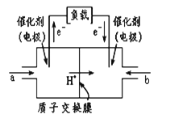
A.该电池提供1mole-,消耗氧气0.5mol
B.正极反应式为O2+2H2O+4e-=40H-
C.负极反应式为CH3OH+H2O+6e-=CO2↑+6H+
D.左电极为电池的负极,a处通入的物质是甲醇
科目:高中化学 来源: 题型:
【题目】某烃A蒸汽的密度是相同状况下氢气密度的36倍,已知该烃中碳、氢元素的质量比为5:1,回答下列问题:
(1)该烃的相对分子质量为__________________。
(2)该烃的分子式为__________________。
(3)该烃有____________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl﹣和SO42﹣。则该硬水属于_____(填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加______后加___________。
(2)我国规定饮用水的硬度不能超过25度,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10mg CaO称为1度,某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT﹣(铬黑T)═MEBT+
蓝色 酒红色
M2+(金属离子)+Y4﹣(EDTA)═MY2﹣
MEBT++Y4﹣(EDTA)═MY2﹣+EBT﹣(铬黑T )
实验过程:
①取地下水样品25.00mL进行预处理,写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:_______________。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是______________。
③将处理后的水样转移到250mL的锥形瓶中,加入氨水﹣氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00molL﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为________________。
(3)某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
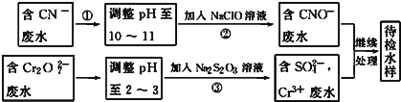
回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为______________________。
②含Cr3+废水需进一步处理,请你设计一个处理方案:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.反应:![]() 在温度为298K时能自发进行,则它的
在温度为298K时能自发进行,则它的![]() ,
,![]()
B.![]()
![]() 溶液加蒸馏水稀释,溶液的pH不断减小
溶液加蒸馏水稀释,溶液的pH不断减小
C.铅蓄电池放电时,正极和负极的质量均增加
D.恒温恒容条件下可逆反应:![]() ,达平衡后,若向平衡体系中加入一定量的A,新平衡体系中,B的物质的量分数一定不变
,达平衡后,若向平衡体系中加入一定量的A,新平衡体系中,B的物质的量分数一定不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是( )
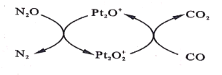
A.N2O转化成无害气体时的催化剂是![]()
B.每1molPt2O+转化为Pt2O![]() 得电子数为2NA
得电子数为2NA
C.将生成的CO2通人含大量![]() 、Na+、Cl-的溶液中,无明显现象
、Na+、Cl-的溶液中,无明显现象
D.1gCO2、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究发现硼氢化钠(NaBH4)在催化剂Ru表面与水反应可生成H2,其反应机理如图所示:
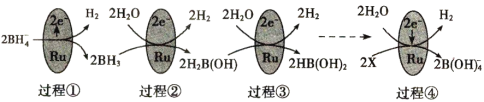
根据以上信息判断,下列叙述错误的是
A.过程①至过程④中硼元素的化合价不变
B.X是H3BO3,H3BO3和BH3两分子中H的化合价相等
C.过程③和过程④各产生1molH2时转移的电子数不相等
D.0.25molNaBH4的还原能力与标准状况下22.4LH2的还原能力相当(还原能力即生成H+失去电子的量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如图:
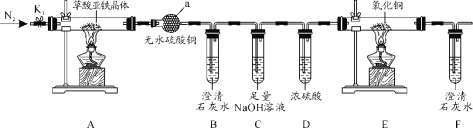
(1)仪器a的名称是___。
(2)从绿色化学考虑,该套装置存在的明显缺陷是___。
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。已知反应中MnO![]() 转化为无色的Mn2+,则该过程中被氧化的元素是___。若反应中消耗lmolFeC2O4·2H2O,则参加反应的n(KMnO4)=___。
转化为无色的Mn2+,则该过程中被氧化的元素是___。若反应中消耗lmolFeC2O4·2H2O,则参加反应的n(KMnO4)=___。
(4)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验试剂是___。
(5)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示:
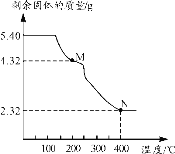
①图中M点对应物质的化学式为___。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出该化合物与稀盐酸反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
B. 1mol Na2O2与足量的水反应,转移的电子数为2NA
C. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D. 0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知PbI2的Ksp=7.0×10-9,将7.5×10-3 mol/L的KI与一定浓度的Pb(NO3)2溶液按2∶1体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为
A.8.4×10-4mol/LB.5.6×10-4mol/L
C.4.2×10-4mol/LD.2.8×10-4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com