
【题目】工业上通常用下列方法治理含氮化合物的污染.
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.写出NOx与CO催化转化成N2和CO2的化学方程式______.
(2)用NH3还原NOx生成N2和H2O.现有NO、NO2的混合气3L,可用同温同压下3.5L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为______.
(3)电化学降解治理水中硝酸盐污染.在酸性条件下,电化学降解NO的原理如图1,阴极反应式为______.

(4)科研小组研究铁屑对地下水脱氮的反应原理.
①pH=2.5时,用铁粉还原KNO3溶液,相关离子浓度、pH随时间的变化关系如图2(部分副反应产物曲线略去).请根据图中信息写出t1时刻前发生反应的离子方程式______,t1时刻后,反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是______.
②pH=2.5时,将铁屑和活性炭同时加入硝酸钾溶液中,可以加快脱氮速率,其原因是______.通常地下水中含有CO32﹣,会降低脱氮效果,其原因为____________________.
【答案】 2NOx+2xCO![]() N2(g)+2xCO2 1:3 2NO+12H++10e﹣=N2↑+6H2O 4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O 生成的Fe2+水解 活性炭和铁构成了原电池,加快反应速率 Fe2+ 与CO32﹣反应生成的难溶物覆盖在反应物的表面阻止反应进行(或者CO32﹣+H2OHCO3﹣+OH﹣,溶液酸性减弱,脱氮效果降低)
N2(g)+2xCO2 1:3 2NO+12H++10e﹣=N2↑+6H2O 4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O 生成的Fe2+水解 活性炭和铁构成了原电池,加快反应速率 Fe2+ 与CO32﹣反应生成的难溶物覆盖在反应物的表面阻止反应进行(或者CO32﹣+H2OHCO3﹣+OH﹣,溶液酸性减弱,脱氮效果降低)
【解析】本题主要考查NOx等含氮化合物的性质。
(1)NOx与CO催化转化成N2和CO2的化学方程式:2NOx+2xCO![]() N2(g)+2xCO2。
N2(g)+2xCO2。
(2)根据电子守恒可得V(NO)+V(NO2)=3L和2V(NO)+4V(NO2)=3V(NH3)=3×3.5L,解得V(NO)=0.75L和V(NO2)=2.25L,则原混合气体中NO和NO2的物质的量之比等于体积之比为1:3。
(3)在阴极NO被还原为N2,阴极反应式为2NO+12H++10e﹣=N2↑+6H2O。
(4)①t1时刻前c(NO3﹣)减小,c(NH4+)增大,pH增大,t1时刻前发生反应的离子方程式:4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O,t1时刻后,反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是生成的Fe2+水解。
②pH=2.5时,将铁屑和活性炭同时加入硝酸钾溶液中,可以加快脱氮速率,其原因是活性炭和铁构成了原电池,加快反应速率。通常地下水中含有CO32﹣,会降低脱氮效果,其原因为Fe2+ 与CO32﹣反应生成的难溶物覆盖在反应物的表面阻止反应进行(或者CO32﹣+H2OHCO3﹣+OH﹣,溶液酸性减弱,脱氮效果降低)。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B. 10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=11
C. 在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D. 0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物用途非常广泛,如二茂铁可用作火箭燃料添加剂,铁酸锶用于直流电机永久陶瓷磁铁。用环戊二烯钠法制备二茂铁(如图)的原理为:C5H6+NaOH→C5H5Na+H2O;2C5H5Na+FeCl2→(C5H5)2Fe+2NaCl。
(1)铁元素的基态价电子排布式为________________。
(2)基态Na原子中,核外电子占据的最高能级的符号是________,占据该能层电子的电子云轮廓图形状为________。Na和K属于同一主族,但金属Na的熔点比金属K高,原因是________________________________________。
(3)(C5H5)2Fe中阴离子![]() 中的σ键总数为____个。分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则
中的σ键总数为____个。分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则![]() 中的大π键应表示为________________。
中的大π键应表示为________________。
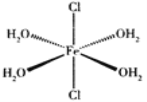
(4)用二乙胺法合成二茂铁的原料有(C2H5)2NH、FeCl2·4H2O及C5H6。FeCl2·4H2O是一种配合物,其结构如图所示,Fe2+与配体之间形成的化学键称为____________。
(5)铁酸锶的晶胞结构如下图所示:
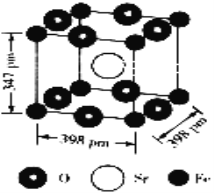
①晶胞中距离最近的两个氧原子的距离为________________cm(列出计算表达式即可)。
②该晶体的密度为_______________________g·cm-3(列出计算表达式即可)。(相对原子质量:Fe:56 Sr:88 O:16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中A,B两种物质间的转化反应中,A,B物质的量随时间变化的曲线如图所示,由图中数据分析得: 
(1)该反应的化学方程式为
(2)反应开始至4min时,A的平均反应速率为 .
(3)4min时,反应是否达到平衡状态?(填“是”或“否”), 8min时,v(正)v(逆)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A,B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍.试回答:
(1)这四种元素分别是:A , B , C , D . (填元素符号)
(2)A,B,C元素各自形成的氢化物的稳定性由强到弱的顺序是 (填化学式,下同)
(3)A与B形成的三原子分子的电子式是 , B与D形成的原子个数比为1:1的化合物的电子式是 .
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是( ) 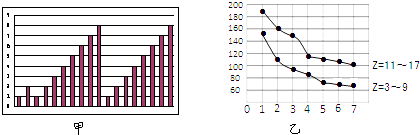
A.图甲横坐标为原子序数,纵坐标表示元素的最高正价
B.图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm)
C.图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm)
D.图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍 ![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→ ![]() X+
X+ ![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )
A.X的氢氧化物是一种强碱
B.X元素位于第六周期
C.X的碳酸盐难溶于水
D.X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组采用分类思想、利用抽象方程式:A+H2O→B+C总结相关物质的知识。
(1)若A为单质:
①金属氧化物B常作为磁性材料,则元素A在周期表中的位置为_________。
②A是一种黄绿色气体单质,则生成物中弱电解质的结构式为_________。
③B能腐蚀玻璃,单质C为空气的主要成分之一,写出该反应的化学方程式: _________。
(2)若A为氧化物:
①A为淡黄色固体,则A的电子式为_________。
②A、C均能造成光化学烟雾,则生成1molB转移的电子数目为_________。
(3)若B俗称酒精,C是生活中食用醋的主要成分,则有机物A的名称是_________。另外,A为盐时还可能发生盐类的水解,用以总结水解的规律及微粒浓度的关系等知识。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol/L的盐酸分别滴定20.00mL浓度均为0.10mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示。

下列说法不正确的是
A. Ⅱ表示的是滴定氨水的曲线,当V(HC1)=20mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH4+)=c(Cl-)
C. 滴定氢氧化钠溶液,V(HCl) >20 mL 时一定有: c(Cl-) >c(Na+) >c(H+) >c(OH-)
D. 当滴定氨水消耗V(HC1)=10 mL 时,有: 2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com