
【题目】某温度时,在2L容器中A,B两种物质间的转化反应中,A,B物质的量随时间变化的曲线如图所示,由图中数据分析得: 
(1)该反应的化学方程式为
(2)反应开始至4min时,A的平均反应速率为 .
(3)4min时,反应是否达到平衡状态?(填“是”或“否”), 8min时,v(正)v(逆)(填“>”、“<”或“=”).
【答案】
(1)2A?B
(2)0.05mol/L?min
(3)否;=
【解析】解:(1)图象分析A为反应物,B为生成物,物质的量不变化说明反应达到平衡状态,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol﹣0.2mol=0.6mol;B变化物质的量=0.5mol﹣0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2AB,所以答案是:2AB;(2)反应开始至4min时,A物质的量变化=0.8mol﹣0.4mol=0.4mol,A的平均反应速率= ![]() =0.05mol/Lmin,所以答案是:0.05mol/Lmin;(3)图象分析随时间变化AB物质的量发生变化,说明未达到平衡,8分钟时AB物质的量不变,说明反应达到平衡状态,所以答案是:否;=.
=0.05mol/Lmin,所以答案是:0.05mol/Lmin;(3)图象分析随时间变化AB物质的量发生变化,说明未达到平衡,8分钟时AB物质的量不变,说明反应达到平衡状态,所以答案是:否;=.
【考点精析】利用反应热和焓变对题目进行判断即可得到答案,需要熟知在化学反应中放出或吸收的热量,通常叫反应热.


科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、W 四种元素分别是元素周期表中连续 3 个短周期的元素,且原子序数 依次增大.X、W 同主族,Y、Z 为同周期的相邻元素.W 原子的质子数等于 Y、Z 原子最 外层电子数之和.Y 与 X 形成的分子中有 3 个共价键.Z 原子最外层电子数是次外层电子 数的 3 倍.试推断:
(1)Z 离子的结构示意图 .
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式 为;含有离子键和共价键的化合物的化学式为 .
(3)由 X、Y、Z 所形成的常见离子化合物是 (写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为 .
(4)用电子式表示W与Z形成W2Z化合物的形成过程: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(原创)下列物质分类正确的是
A.SO2、SiO2、P2O5均为酸性氧化物
B.是否具有丁达尔效应是胶体与溶液、浊液的根本区别
C.纯净盐酸为纯净物、冰水混合物为混合物
D.烧碱、纯碱都属于碱,油脂、甘油都属于酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C为短周期元素,在周期表中所处的位置如表所示.
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数.
(1)写出B,C元素的名称、 .
(2)B位于元素周期表中第周期第族.
(3)用石墨为电极,电解B元素的最高价氧化物的水化物的水溶液,当电路中转移0.4mol电子时,在阴极收集到的产物是 , 质量为g,电解的总反应方程式为;
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) ![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
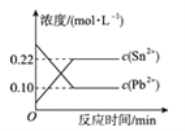
A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
C. 25 ℃时,该反应的平衡常数K=2.2
D. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常用下列方法治理含氮化合物的污染.
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.写出NOx与CO催化转化成N2和CO2的化学方程式______.
(2)用NH3还原NOx生成N2和H2O.现有NO、NO2的混合气3L,可用同温同压下3.5L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为______.
(3)电化学降解治理水中硝酸盐污染.在酸性条件下,电化学降解NO的原理如图1,阴极反应式为______.

(4)科研小组研究铁屑对地下水脱氮的反应原理.
①pH=2.5时,用铁粉还原KNO3溶液,相关离子浓度、pH随时间的变化关系如图2(部分副反应产物曲线略去).请根据图中信息写出t1时刻前发生反应的离子方程式______,t1时刻后,反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是______.
②pH=2.5时,将铁屑和活性炭同时加入硝酸钾溶液中,可以加快脱氮速率,其原因是______.通常地下水中含有CO32﹣,会降低脱氮效果,其原因为____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H<0,下列有关叙述正确的( )
A.上述反应的化学反应速率关系:2 v(NH3)=3 v(H2O)
B.若在2L的密闭容器中反应,经过3min后NH3的物质的量由10mol变为7mol 则v (NH3)=0.5molL﹣1s﹣1
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若降低温度,反应速率将会减小且平衡将被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.制陶的主要原料是石英砂
B.制作陶器一般分为制泥、成型、干燥、烧成等步骤
C.制陶过程中温度越高越好,这样制得的陶器牢固
D.在氧化气氛中烧制得灰陶,在还原气氛中得红陶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com