
【题目】已知 X、Y、Z、W 四种元素分别是元素周期表中连续 3 个短周期的元素,且原子序数 依次增大.X、W 同主族,Y、Z 为同周期的相邻元素.W 原子的质子数等于 Y、Z 原子最 外层电子数之和.Y 与 X 形成的分子中有 3 个共价键.Z 原子最外层电子数是次外层电子 数的 3 倍.试推断:
(1)Z 离子的结构示意图 .
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式 为;含有离子键和共价键的化合物的化学式为 .
(3)由 X、Y、Z 所形成的常见离子化合物是 (写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为 .
(4)用电子式表示W与Z形成W2Z化合物的形成过程: .
【答案】
(1)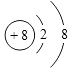
(2)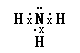 ;Na2O2
;Na2O2
(3)NH4NO3;NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
(4)![]()
【解析】解:Z原子最外层电子数是次外层电子数的3倍,Z原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y与X形成的分子中有3个共价键,四种元素分别是元素周期表中连续 3 个短周期的元素,Y的原子序数小于O元素,则Y为N元素、X为H元素;W原子的质子数等于Y、Z原子最外层电子数之和,W原子质子数=5+6=11,则W为Na元素,(1)Z为O元素,氧离子的核电荷数为8、核外电子总数为10,其离子结构示意图为: 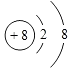 ,所以答案是:
,所以答案是: 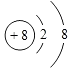 :(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物是氨气,氨气的电子式为
:(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物是氨气,氨气的电子式为  ; 含有离子键和非极性共价键的化合物为过氧化钠,过氧化钠的化学式为:Na2O2 ,
; 含有离子键和非极性共价键的化合物为过氧化钠,过氧化钠的化学式为:Na2O2 ,
所以答案是:  ;Na2O2;(3)由X、Y、Z所形成的常见离子化合物是NH4NO3 , W的最高氧化物的水化物为NaOH,二者反应的离子方程式为:NH4++OH﹣
;Na2O2;(3)由X、Y、Z所形成的常见离子化合物是NH4NO3 , W的最高氧化物的水化物为NaOH,二者反应的离子方程式为:NH4++OH﹣ ![]() NH3↑+H2O,
NH3↑+H2O,
所以答案是:NH4NO3;NH4++OH﹣ ![]() NH3↑+H2O;(4)W2Z为Na2O,氧化钠属于离子化合物,用电子式表示氧化钠的形成过程为
NH3↑+H2O;(4)W2Z为Na2O,氧化钠属于离子化合物,用电子式表示氧化钠的形成过程为 ![]() ,
,
所以答案是: ![]() .
.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO﹣和ClO3﹣两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( ) 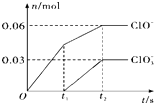
A.Cl2和苛性钾溶液在不同温度下可能发生不同反应
B.反应中转移电子数为是0.21 NA
C.原苛性钾溶液中KOH的物质的量无法确定
D.生成物中Cl﹣的物质的量为 0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化工生产的主要设备及尾气的主要成分完全正确的是( )
A.炼铁—电炉—CO、CO2、N2
B.氨气—氧化炉—N2、H2
C.炼钢—转炉—Fe2O3、CO
D.硫酸—合成塔—SO2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.某校课外兴趣小组以两条途径分别对X进行如下实验探究: 途径a: 
途径b: 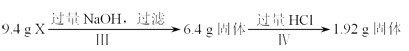
下列有关说法不正确的是( )
A.1.92g固体只含Cu
B.由Ⅰ可知X中一定存在Fe2O3和Cu
C.原混合物中m(Fe2O3):m(Cu)=1:1
D.原混合物X至少含Al2O3和SiO2中的一种,但不能进一步确认二者的存在与否
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修5——有机化学基础】
某新型有机化学材料G的合成路线如图所示,请回答下列问题:
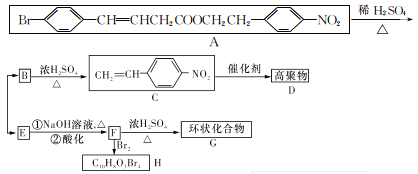
(1)F分子中的含氧官能团名称为_______。
(2)高聚物D的结构简式是_______。
(3)写出反应A→B+E的化学方程式:________。
(4)F→H的反应类型有______、_________。
(5)B的同分异构体有多种,其中官能团种类不变,能与FeCl3溶液发生显色反应,核磁共振氢谱显示有6组峰,且峰面积之比为1:1:1: l:2:3的同分异构体有_____种。
(6)参照上述合成路线,以CH3CHBrCOOCH3为原料(无机试剂任选),设计制备聚乳酸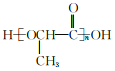 的合成路线_____________________。
的合成路线_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为_____。
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填字母序号,下同).
A.c(H+) B.![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D.![]() E.
E. 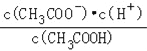
若升高该溶液温度(不考虑醋酸挥发),上述5种表达式的数据增大的是_____.
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中水电离出来的c(H+),理由是_____.
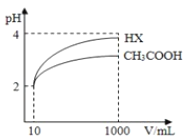
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B. 10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=11
C. 在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D. 0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中A,B两种物质间的转化反应中,A,B物质的量随时间变化的曲线如图所示,由图中数据分析得: 
(1)该反应的化学方程式为
(2)反应开始至4min时,A的平均反应速率为 .
(3)4min时,反应是否达到平衡状态?(填“是”或“否”), 8min时,v(正)v(逆)(填“>”、“<”或“=”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com