
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为_____。
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填字母序号,下同).
A.c(H+) B.![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D.![]() E.
E. 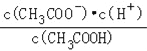
若升高该溶液温度(不考虑醋酸挥发),上述5种表达式的数据增大的是_____.
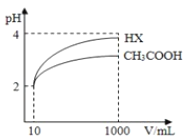
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中水电离出来的c(H+),理由是_____.
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____。
【答案】 CO32﹣>ClO﹣>HCO3﹣>CH3COO﹣ A ABCE 大于 大于 HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱 碱 11:9
【解析】(1)酸根离子对应酸的酸的电离平衡常数越大,则其结合氢离子能力越弱,由于电离平衡常数CH3COOH>H2CO3>HCO3﹣>HClO,则同浓度CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为:CO32﹣>ClO﹣>HCO3﹣>CH3COO﹣;(2)A.0.1mol·L﹣1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小,选项A正确;B.0.1mol·L﹣1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,则![]() 增大,选项B错误;C.Kw=c(H+)·c(OH﹣)只受温度的影响,温度不变则其值是一个常数,选项C错误;D.醋酸稀释,酸性减弱,c(H+)减小,水的离子积不变,则c(OH﹣)增大,所以
增大,选项B错误;C.Kw=c(H+)·c(OH﹣)只受温度的影响,温度不变则其值是一个常数,选项C错误;D.醋酸稀释,酸性减弱,c(H+)减小,水的离子积不变,则c(OH﹣)增大,所以![]() 增大,选项D错误;E.
增大,选项D错误;E.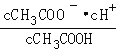 为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,选项E错误;答案选A;若该溶液升高温度,醋酸、水的电离程度对增大,则溶液中氢离子、氢氧根离子浓度都增大,A.升高温度后溶液中氢离子浓度c(H+)增大,选项A正确;B.升高温度后氢离子、氢氧根离子浓度都增大,醋酸的浓度减小,则
为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,选项E错误;答案选A;若该溶液升高温度,醋酸、水的电离程度对增大,则溶液中氢离子、氢氧根离子浓度都增大,A.升高温度后溶液中氢离子浓度c(H+)增大,选项A正确;B.升高温度后氢离子、氢氧根离子浓度都增大,醋酸的浓度减小,则![]() 的比值增大,选项B正确;C.c(H+)·c(OH﹣)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,选项C正确;D.升高温度后氢氧根离子、氢离子浓度都增大,但氢氧根离子浓度增大的幅度大于氢氧根离子,所以
的比值增大,选项B正确;C.c(H+)·c(OH﹣)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,选项C正确;D.升高温度后氢氧根离子、氢离子浓度都增大,但氢氧根离子浓度增大的幅度大于氢氧根离子,所以![]() 的比值减小,选项D错误;E.
的比值减小,选项D错误;E.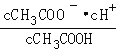 为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,选项E正确;答案选ABCE;(3)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大;HX酸性强于CH3COOH的,稀释后HX溶液中c(H+)小于CH3COOH溶液中的c(H+),所以其对水的抑制能力减弱;(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,c(H+)=10-7mol/L,c(OH-)=
为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,选项E正确;答案选ABCE;(3)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大;HX酸性强于CH3COOH的,稀释后HX溶液中c(H+)小于CH3COOH溶液中的c(H+),所以其对水的抑制能力减弱;(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,c(H+)=10-7mol/L,c(OH-)=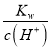 =
=![]() =10-5mol/L,c(H+)< c(OH-),溶液显碱性;PH=1的H2SO4溶液c(H+)=0.1mol/L,PH=11的NaOH溶液c(OH-)=
=10-5mol/L,c(H+)< c(OH-),溶液显碱性;PH=1的H2SO4溶液c(H+)=0.1mol/L,PH=11的NaOH溶液c(OH-)=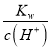 =
=![]() =0.1mol/L,将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,证明酸过量,则
=0.1mol/L,将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,证明酸过量,则![]() =10-2mol/L,解得a:b=11:9。
=10-2mol/L,解得a:b=11:9。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】盐酸多巴胺是选择性血管扩张药,临床上用作抗休克药,合成路线如图所示:

根据上述信息回答:
(1)D的官能团名称为________________________________。
(2)E的分子式为_________________________。
(3)若反应①为加成反应,则B的名称为__________________。
(4)反应②的反应类型为___________________________。
(5)D的一种同分异构体K用于合成高分子材料,K可由HOO![]() CH2Cl制得,写出K在浓硫酸作用下生成的聚合物的化学方程式:_______________________________________。
CH2Cl制得,写出K在浓硫酸作用下生成的聚合物的化学方程式:_______________________________________。
(6)E生成F的化学反应方程式为________________________。
(7)D的同分异构体有多种,同时满足下列条件的有____种。
I.能够发生银镜反应;
II.遇FeCl3溶液显紫色;
III.苯环上只有两种化学环境相同的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、W 四种元素分别是元素周期表中连续 3 个短周期的元素,且原子序数 依次增大.X、W 同主族,Y、Z 为同周期的相邻元素.W 原子的质子数等于 Y、Z 原子最 外层电子数之和.Y 与 X 形成的分子中有 3 个共价键.Z 原子最外层电子数是次外层电子 数的 3 倍.试推断:
(1)Z 离子的结构示意图 .
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式 为;含有离子键和共价键的化合物的化学式为 .
(3)由 X、Y、Z 所形成的常见离子化合物是 (写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为 .
(4)用电子式表示W与Z形成W2Z化合物的形成过程: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨( )
A.有放射性
B.易燃、易爆
C.能导电
D.有剧毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
(1)将钠、铝、钾各 1mol 分别投入到足量的相同浓度的盐酸中,试预测实验结果:与盐酸 反应最剧烈的单质是 , 与盐酸反应产生的气体最多的是 .
(2)向 Na2S 溶液中通入氯气出现黄色浑浊,可证明 Cl 的非金属性比 S 强,反应离子方程式 为 .
(3)利用如图装置可验证同主族元素非金属性的变化规律:仪器 A 的名称为 , 装置 D 的作用为; 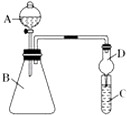
①若要证明非金属性:Cl>I,则 A 中加浓盐酸,B 中加 KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C 中加淀粉碘化钾混合溶液,观察到 C 中溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
②若要证明非金属性:C>Si,则在 A 中加盐酸、B 中加 CaCO3、C 中加 Na2SiO3 溶液,观察到 C 中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入 C 中干扰实验,应在两装置间添加装有溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) ![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
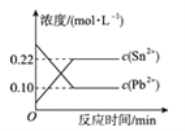
A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
C. 25 ℃时,该反应的平衡常数K=2.2
D. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com