
����Ŀ��ij��ѧС��������װ����ȡ�ռ����������������о������ʡ���ش��������⡣

(1)װ�ü�������A��������_____________������Ӧװ����Һ��________________����װ���з�����Ӧ�����ӷ���ʽΪ__________________________________________________����ȡ�ռ�����������װ�ýӿ�����˳����a�� _____________��g(��������)��
(2)�Ʊ���Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ�̽��С��ͬѧ�������ʵ�鷽����
I������������AgNO3��Һ��Ӧ���������ɵ�AgCl������
������������к͵ζ����ⶨ��
��������֪��CaCO3(����)��Ӧ������ʣ���CaCO3������
�̶����������жϺ�ʵ�飺
���ж�I���������У�������____________��
�ڽ��Т�ʵ�飺ȷ��ȡ������Һϡ��һ����������Ϊ������
a.��ȡ����20.00mL����ƿ�У�����ƿ�д�������ˮ����ʵ�����Ƿ���Ӱ�죿_____������������������)��0.10 molL-1NaOH����Һ�ζ�������NaOH����Һ�������ͼ��ʾ�������Ϊ_____ mL��

b��ƽ�еζ�����ʵ������
���жϢ���ʵ����___________(����ƫ��������ƫС������ȷ��)��[��֪��Ksp(CaCO3)��2.8��10-9��Ksp(MnCO3)��2.3��10-11
(3)ijͬѧ��Ϊ���������������Ե�ȱ�ݣ���ָ��_______________________________��
���𰸡���Һ©�� ����NaCl��Һ MnO2��4H++2Cl-![]() Mn2+��Cl2����2H2O debcf ����Һ�е�MnCl2 Ҳ����AgNO3��Ӧ�γɳ��� �� 22.60 ƫС û��β������װ��
Mn2+��Cl2����2H2O debcf ����Һ�е�MnCl2 Ҳ����AgNO3��Ӧ�γɳ��� �� 22.60 ƫС û��β������װ��
��������
��1����Ϥ������������״��˵�������ƣ�����������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ��Ũ�����ӷ����Ʊ������������Ȼ��⣬����Ȼ��⡢�����ڱ���ʳ��ˮ���ܽ���ص�ѡ����ʵij��Ӽ���������װ�����ý�������
��2���٢�������������Ũ���ᷴӦ�����Ȼ��̣��Ȼ���Ҳ������������Ӧ��
�ڢ�����ƿ�к�����ˮ����Ӱ�����������ʵ���������ͼ����ȡ���ݣ�
�ۢ�������֪��CaCO3����������Ӧ������ʣ���CaCO3���������ڲ���̼���ת����̼���̳���������ʣ��Ĺ���������ƫ��
��3�������ж���ֱ���ŷ��ܹ�������Ⱦ��
��1��װ�ü�������A������Ϊ��Һ©��������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ�����ӷ���ʽΪMnO2��4H++2Cl-![]() Mn2+��Cl2����2H2O����װ��������ȡ������AΪ��Һ©�������μ�Ũ����Ӽ�װ�ó��������庬�Ȼ����ˮ������Ũ���������ˮ�ԣ�װ������Ũ��������ø����������Ȼ���������ˮ�������ڱ���ʳ��ˮ���ܽ�Ⱥ�С������װ�ñ��п���ʢ�ű���ʳ��ˮ��ȥ�����е��Ȼ��⣬��������ͨ���������ȳ��Ӻ��������ܶȱȿ����ܶȴ��������������ռ��������̳�������ȷ��˳��Ϊ��a��d��e��b��c��f��g���ʴ�Ϊ����Һ©��������NaCl��Һ��MnO2+4H++2Cl=Mn2++Cl2��+2H2O�� debcf��
Mn2+��Cl2����2H2O����װ��������ȡ������AΪ��Һ©�������μ�Ũ����Ӽ�װ�ó��������庬�Ȼ����ˮ������Ũ���������ˮ�ԣ�װ������Ũ��������ø����������Ȼ���������ˮ�������ڱ���ʳ��ˮ���ܽ�Ⱥ�С������װ�ñ��п���ʢ�ű���ʳ��ˮ��ȥ�����е��Ȼ��⣬��������ͨ���������ȳ��Ӻ��������ܶȱȿ����ܶȴ��������������ռ��������̳�������ȷ��˳��Ϊ��a��d��e��b��c��f��g���ʴ�Ϊ����Һ©��������NaCl��Һ��MnO2+4H++2Cl=Mn2++Cl2��+2H2O�� debcf��
��2���٢������С���Ӧ����Һ�е��������������Ӧ�����Ȼ����������������̺�Ũ���ᷴӦ���ɵ��Ȼ���Ҳ������������Ӧ�����Ȼ����������ʳ������ɵ�AgCl������ֻ����������ӵ����ʵ��������������ʣ�������Ũ�ȡ���С���Ϊ������Һ�е�MnCl2Ҳ����AgNO3��Ӧ�γɳ�����
�ڢ�����ƿ�к�����ˮ����Ӱ�����������ʵ���������ͼ����ȡ����Ϊ��22.60mL����С���Ϊ������22.60��
�ۢ�������Ksp��CaCO3��=2.8��10-9 ��Ksp(MnCO3)��2.3��10-11֪��̼���̵�Ksp��̼���С�����ڲ���̼���ת����̼���̳���������ʣ��Ĺ���������ƫ����ʵ����ƫС����С���Ϊ��ƫС��
��3�������ж�ֱ���ŷŻ���Ⱦ������������ȱ��β������װ�á���С���Ϊ��û��β������װ�á�


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ˮ��ɹ�ɵô���,�����г�����NaCl��,������![]() �Լ���ɳ�����ʡ��Ʊ����εĸ���������������:
�Լ���ɳ�����ʡ��Ʊ����εĸ���������������:

(1)�ڵڢ߲�����������Ҫ�ò���������,Ŀ����__________��
(2)�ڢڡ��ܲ�������Ŀ�ķֱ��dz�ȥ�����е�![]() ��
��![]() ,��Ҫ������Լ�������________(�ѧʽ)��
,��Ҫ������Լ�������________(�ѧʽ)��
(3)�ڢ������з�����Ӧ�Ļ�ѧ����ʽΪ________��
(4)�ڵڢ۲�������,ѡ��ij����Լ�������KOH��Һ,������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͬ��ѧԪ������ɵĻ��������˵���������

A.����Ϊij�ִ���ӵ���ɵ�λ�����������ǰ�����
B.�����ǡ�������ȼ�ϡ�����ڿ�����������
C.����Ϊ��Я���Ŵ���Ϣ�Ĵ�������ʣ����һ����DNA
D.����Ϊ���붯��ѪҺ��֬����������ʣ���ܿ���Ϊ���̴�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]�������£���0. 10 mol/LHX��Һ�еμ�0.10 mol/L NaOH��Һ����ҺpH��p[c(HX)/c(X-)]�仯��ϵ��ͼ������˵������ȷ����
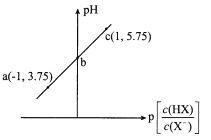
A. ��Һ��ˮ�ĵ���̶ȣ�a<b<cB. ͼ��b������Ϊ(0��4.75)
C. c����Һ�У�c(Na+) =l0c(HX)D. ������HX�ĵ��볣��Ϊ10-4. 75
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���������·�Ӧ��ȡP4��2Ca(PO4)2 +6SiO2+10C![]() 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
�ش��������⣺
(1)��̬��ԭ�ӵĺ�������Ų�ʽΪ___��
(2)Si��P��SԪ�ص�һ�����ܴ�С��ϵΪ___��
(3)P4��Pԭ�ӵ��ӻ���ʽ��___ ��P4�Ŀռ�ṹΪ___ �����ǡ�PPP=___��
(4)��CO��Ϊ�ȵ��ӵ���������___ (�ѧʽ)��
(5)���������ʯ�ṹ���ƣ���ͼΪ�����ľ����ṹ����֪��ԭ�ӵİ뾶Ϊr nm���������ܶ���___g/cm3��
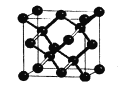
(6)��ĺ��������ﶼ�Թ���������(SiO4)��Ϊ�����ṹ��Ԫ����ͼa��ʾ���ɼ�Ϊͼb��

�衢��ԭ��ͨ��������ԭ���γɸ��ֲ�ͬ�Ĺ���������ӣ���ͼc��ͼd��ͼc�Ļ�ѧʽ____________�����������Ĺ�����й���ԭ��֮��Ϊ____��

�衢��ԭ�ӳ����γɳ����⣬Ҳ���γɲ�״��������״�ṹ����������״�ṹ�У��衢��ԭ����֮��Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20����50�����ѧ������۲���ӶԻ���ģ�ͣ����VSEPRģ�ͣ�������Ԥ���������ṹ����Ҫ����Ը���Ϊ��
����AXnEm��ʾֻ��һ������ԭ�ӵķ��ӣ�AΪ����ԭ�ӣ�XΪ������ԭ�����ϵ�ԭ�ӣ�EΪ����ԭ�������δ����ɼ��ĵ��Ӷԣ���Ϊ�¶Ե��ӣ�����n+m����Ϊ�۲���Ӷ����������еļ۲���Ӷ����ǻ����ų⣬���ȵķֲ�������ԭ����Χ�Ŀռ䣻
���ӵ����幹����ָ�����е�ԭ���ڿռ���Ų�������������ԭ��δ�ɼ��ŶԵ��ӣ�
�����м۲���Ӷ�֮��ij�������Ҫ˳��Ϊ��
i���¶Ե���֮��ij������¶Ե��Ӷ��빲�õ��Ӷ�֮��ij��������õ��Ӷ�֮��ij�����
ii��˫����˫��֮��ij�����˫���뵥��֮��ij����������뵥��֮��ij�����
iii��Xԭ�ӵõ�������Խ����A��X�γɵĹ��õ��Ӷ�֮��ij���Խǿ��
iv��������
����ϸ�Ķ��������ϣ��ش��������⣺
��1������Ҫ��I���Ի���AXnEm��VSEPR����ģ�ͣ�����д�±�__��

��2��H2O���ӵ����幹��Ϊ��__������Ԥ��ˮ�����С�H��O��H�Ĵ�С��Χ__��
��3��SO2Cl2��SO2F2����AX4E0�ͷ��ӣ�S=O֮����˫����ϣ�S��Cl��S��F֮���Ե�����ϣ�����Ԥ��SO2Cl2��SO2F2���ӵ����幹�ͣ�__��SO2Cl2�����С�Cl��S��Cl__��ѡ���������������=����SO2F2�����С�F��S��F��
��4���ü۲���ӶԻ������ۣ�VSEPR���ж�SO32�����ӵĿռ乹�ͣ�__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ���ڵ�X��Y��Z����Ԫ�ص�����������Ӧˮ�����������ǿ������˳���ǣ�HZO4![]() H2YO4
H2YO4 ![]() H3XO4�������ж���ȷ���� �� ��
H3XO4�������ж���ȷ���� �� ��
�������ӵĻ�ԭ��X��Y��Z˳�����
�����ʵ�������X��Y��Z˳����ǿ
��Ԫ�ص�ԭ�Ӱ뾶��X��Y��Z˳���С
����̬�⻯����ȶ���X��Y��Z˳�����
�٢�A. �ڢ� B. �٢ڢ� C. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Բ����ƿ�м���1 molC2H5OH�ͺ�1molHBr�������ᣬ��Һ�з�����Ӧ��C2H5OH+HBr![]() C2H5Br+H2O����ַ�Ӧ��ﵽƽ�⡣��֪��ѹ�£�C2H5Br��C2H5OH�ķе�ֱ�Ϊ38.4���78.5�档�����й������������
C2H5Br+H2O����ַ�Ӧ��ﵽƽ�⡣��֪��ѹ�£�C2H5Br��C2H5OH�ķе�ֱ�Ϊ38.4���78.5�档�����й������������
A. ����NaOH���������Ҵ������ʵ���
B. ����HBrŨ�ȣ�����������C2H5Br
C. ����Ӧ��������2 mol�������ַ�Ӧ��ƽ��ת����֮�Ȳ���
D. ����ʼ�¶������60�棬�����̷�Ӧ�ﵽƽ���ʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����Ũ�ȵ����������HA��HB��NaHCO3��Ӧ�ų�CO2�������ʱ��Ĺ�ϵ��ͼ��ʾ��������˵��������ǣ�( )

A. ���ԣ�HA<HB
B. pH��Ϊ4��HA��HB��Һ�к͵���NaOHʱ������HA��Һ���С
C. pH��Ϊ9��NaA��Һ��NaB��Һ��ȣ�NaA��Һ��ˮ�ĵ���̶ȴ�
D. Ũ�Ⱦ�Ϊ0.1mol/L��NaA��Һ��NaB��Һ��ȣ�NaA��Һ��ˮ�ĵ���̶ȴ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com