
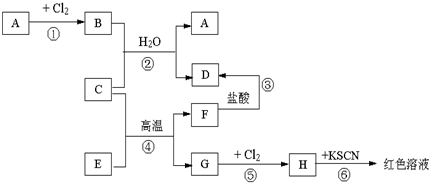
分析 A、C、G是金属,G和氯气反应生成H,H和KSCN反应后溶液呈红色,说明H是FeCl3,所以G是Fe,C是金属单质、E和F是氧化物,G是Fe单质,结合反应条件知④发生铝热反应,则C是Al,F是Al2O3,E是Fe2O3,
A是金属单质,和氯气反应生成氯化物,B溶于水得蓝色溶液,说明B中含有铜离子,根据元素守恒知,B为CuCl2,Al和CuCl2发生置换反应生成Cu和AlCl3,D是AlCl3,氧化铝和盐酸反应生成氯化铝,结合物质的性质分析解答.
解答 解:(1)通过以上分析知,A、D、H分别是:Cu、AlCl3、FeCl3,故答案为:Cu;AlCl3;FeCl3;
(2)铝和氧化铁发生铝热反应生成氧化铝和铁,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)①由金属元素在周期表中的位置可知Al的金属性比Ba弱,故答案为:弱;
②但Al在高温下可将氧化钡中钡置换出来,原因是Ba的沸点低于铝,高温时Ba转化为气体脱离反应体系,使反应正向进行,故答案为:d;
(4)氯化铁具有氧化性,碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质,反应离子方程式为:2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
(5)n(Cu)=$\frac{51.2g}{64g/mol}$=0.8mol,Cu和硝酸恰好完全反应生成NO2、NO,生成物还有Cu(NO3)2,根据N原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2×0.8mol+$\frac{31.36L}{22.4L/mol}$=3mol,c(HNO3)=$\frac{n}{V}$=$\frac{3mol}{0.2L}$=15mol/L,
故答案为:15.
点评 本题以铝、铁为载体考查了无机物的推断,明确物质的性质及物质的特殊反应现象是解本题关键,根据⑥为突破口采用正逆结合的方法进行推断,结合基本概念、物质间的反应分析解答,铁离子的检验是高考热点,会运用化学语言描述实验现象,根据现象得出结论,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、H2S | B. | NH3、CO2 | C. | Cl2、CO2 | D. | SO2、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池在酸性介质中的正极反应式:O2+4H++4e-═2H2O | |
| B. | 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ | |
| D. | 反应HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0,在理论上能用于设计原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 (g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 | |
| B. | 2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2 | |
| D. | S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 |
| n(CO)/mol | 10 | 7 | 5 | 5 |
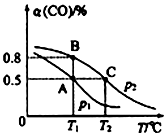
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
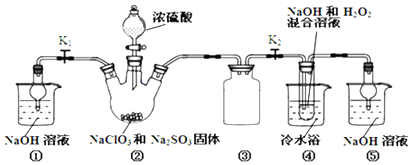
| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
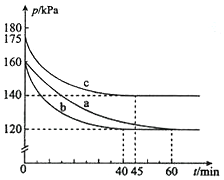
 一定温度下,将1mol A和1mol B气体充入2L密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1mol A和1mol B气体充入2L密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A. | 该反应方程式中的x=l | |
| B. | 0~t1时,用A表示的反应速率υ(A)=0.50mol/(L•min) | |
| C. | t2和t3时,改变的条件分别是加入催化剂和移去少量物质D | |
| D. | t1~t3间,该反应的平衡常数均为4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com