
���� 2����ĩ��Ӧ�ﵽƽ��״̬��������0.8mol D�������C��Ũ��Ϊ0.4mol/L�����ʵ���=0.4mol/L��2L=0.8mol����Ӧ֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ���x��2=0.8��0.8=1��1����x=2�����ݻ�ѧƽ������ʽ��ʽ���㣬
3A��g��+B��g��?2C��g��+2D��g��
��ʼ����mol�� 2 2 0 0
�仯����mol�� 1.2 0.4 0.8 0.8
ƽ������mol�� 1.8 1.6 0.8 0.8
��1��Ũ��c=$\frac{n}{V}$��
��2��ת����=$\frac{������}{��ʼ��}$��100%��
��3����Ӧ����v=$\frac{��c}{��t}$����õ���
��4����С�����������ѹǿ��ƽ��������У�
��� �⣺2����ĩ��Ӧ�ﵽƽ��״̬��������0.8mol D�������C��Ũ��Ϊ0.4mol/L�����ʵ���=0.4mol/L��2L=0.8mol����Ӧ֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ���x��2=0.8��0.8=1��1����x=2�����ݻ�ѧƽ������ʽ��ʽ���㣬
3A��g��+B��g��?2C��g��+2D��g��
��ʼ����mol�� 2 2 0 0
�仯����mol�� 1.2 0.4 0.8 0.8
ƽ������mol�� 1.8 1.6 0.8 0.8
��1��B��ƽ��Ũ��c=$\frac{n}{V}$=$\frac{1.6mol}{2L}$=0.8mol/L��
�ʴ�Ϊ��0.8mol/L��
��2��Aת����=$\frac{������}{��ʼ��}$��100%=$\frac{1.2mol}{2mol}$��100%=60%��
�ʴ�Ϊ��60%��
��3����D��ʾ��ƽ����Ӧ����v=$\frac{��c}{��t}$=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/L•min��
�ʴ�Ϊ��0.2mol/L•min��
��4��3A��g��+B��g��?2C��g��+2D��g������Ӧ�������������ķ�Ӧ����С�����������ѹǿ��ƽ�ⲻ�ƶ���ƽ����ϵ��C�����ʵ���Ũ������ƽ����ϵ��C�������������䣻�����������ƽ���ܶ�����ƽ����Է����������䣮
�ʴ�Ϊ�������䣻�����䣮
���� ���⿼���˻�ѧƽ�����Ӧ�ã���Ҫ�Ƿ�Ӧ�� ץ���ʣ���ѧ��Ӧ���ʸ���ļ���Ӧ�ã����ջ����ǹؼ�����Ŀ�ϼ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4HCO3 | B�� | Cl2 | C�� | CH3COOH | D�� | SO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
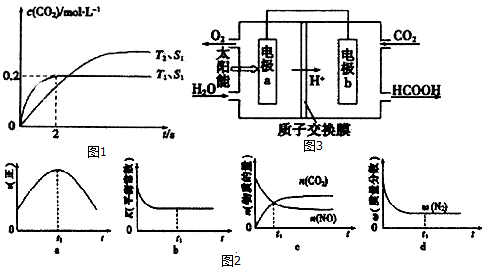
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ�뺤��ʹ�ܱ�������ѹǿ����ƽ��������Ӧ�����ƶ� | |
| B�� | ����X�����ʵ��������������ܶȼ�С | |
| C�� | X������Ӧ������Y���淴Ӧ���ʵ�$\frac{m}{n}$�� | |
| D�� | �����¶ȣ���������ƽ����Է����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��HCl��Һ��������ˮϴ��AgCl�����Լ��ٳ�����ʧ | |
| B�� | ��BaSO4������뵽����Na2CO3��Һ�У���ַ�Ӧ����ˡ�ϴ�ӣ��������еμ�ϡ���ᣬ�������������֤����������Ksp��BaSO4����Ksp��BaCO3�� | |
| C�� | ��ˮ�м���NaHCO3��NaHSO4�����ˮ�ĵ���̶Ⱦ����� | |
| D�� | ��������������ˮ�ⷴӦ������ϡ�������߷�Ӧ���ʺ�����������ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ksp����ֵֻ���¶��й� | |
| B�� | Ksp����ֵֻ�����ܵ���ʵ����ʺ��¶��й� | |
| C�� | Ksp�Ĵ�С��������ж��ٺ���Һ������Ũ�ȵĴ�С�й� | |
| D�� | Ksp����ֵԽ�������ˮ�е��ܽ�����Խǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al65Cu23Fe12��Ӳ�ȱȽ���Al��Cu��Fe��Ӳ�ȴ� | |
| B�� | Al65Cu23Fe12�����ֽ����Ļ��ϼ۾��������� | |
| C�� | Al65Cu23Fe12�����������ڽ����ں�ˮ�еIJ��� | |
| D�� | 1mol Al65Cu23Fe12���ڹ���������ʱ��ʧȥ265 mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ù��Ϊ10mL����Ͳ��ȡ6.20mL��Һ�� | |
| B�� | �����������ƹ��������ʱ���������������ֽ�ϣ�������������ƽ�����̣��������������ƽ������ | |
| C�� | ��������ɳ�ȥҺ̬������зе㲻ͬ���ӷ����ѻӷ��ӷ������� | |
| D�� | �����Ȼ�̼��ȡ��ˮ�еĵ⣬��־��ú��Ϻ�ɫҺ�����ϲ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
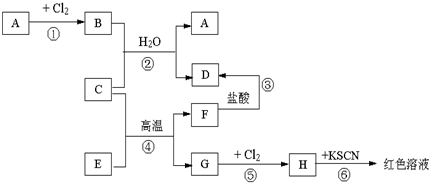
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com