
【题目】钠及其化合物具有广泛的用途。
(1)工业上制备碳酸氢钠的化学方程式为____________。
(2)用Na2CO3熔融作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示,正极的电极反应式为__________。

(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是_______,根据表中数据,浓度均为0.01 mol·L-1下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当100 mL 2mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH<7,则溶液中各离子浓度由大到小的顺序为_______。
②常温下,已知Ksp[Cu(OH)2]=2×10-20, Ksp[CuS]=1.3×10-36。向浓度为0.1mol/L,体积为10mL的氢氧化钠溶液中,逐滴加入浓度为0.1mol/L 硫酸铜溶液至pH=6时Cu2+的浓度为______。向该溶液中滴入一滴0.1mol/L的硫化钠溶液,_______(填“有”或“没有”)CuS沉淀析出。(一滴约为0.05mL)
【答案】 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl O2+4e-+2CO2=2CO32- CO32- c c(Na+)>c(HSO3-)>c(H+) >c(SO32-)>c(OH-) 2×10-4 有
【解析】(1) 工业上制备碳酸氢钠的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;(2)该燃料电池的总反应为:2CO+O2=2CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-;(3)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32-;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、HCO3-四种酸的酸性大小顺序是CH3COOH>HClO>HCN>HCO3-,所以溶液的pH变化最大的是醋酸,答案选c;(4)①100mL2molL-1的NaOH的物质的量=2mol/L×0.1L=0.2mol,标准状况下4.48LSO2的物质的量=![]() =0.2mol,所以氢氧化钠和二氧化硫反应方程式为SO2+NaOH= NaHSO3,由于水解程度小于电离程度,所以溶液中各离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);②pH=6时氢氧根浓度是10-8mol/L,则Cu2+的浓度为
=0.2mol,所以氢氧化钠和二氧化硫反应方程式为SO2+NaOH= NaHSO3,由于水解程度小于电离程度,所以溶液中各离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);②pH=6时氢氧根浓度是10-8mol/L,则Cu2+的浓度为![]() 。向该溶液中滴入一滴0.1mol/L的硫化钠溶液,硫离子浓度是
。向该溶液中滴入一滴0.1mol/L的硫化钠溶液,硫离子浓度是![]() ,此时浓度熵=0.0005×2×10-4>Ksp[CuS],因此有CuS沉淀析出。
,此时浓度熵=0.0005×2×10-4>Ksp[CuS],因此有CuS沉淀析出。


科目:高中化学 来源: 题型:
【题目】为了除去CuCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再向滤液中加入适量盐酸。这种试剂是
A. 稀氨水 B. NaOH溶液 C. 硫氰化钾溶液 D. Cu(OH)2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高聚物的单体A(C11H12O2)可发生以下变化:
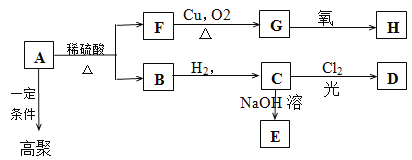
已知: C的烃基部分被取代生成的一氯代物D有两种;F的分子式为C7H8O,含有苯环,但与FeCl3溶液不显色。请回答:
(1)F分子中含有的官能团结构简式是 。
(2)由A生成B和F的反应类型为(选填序号) 。
①氧化反应 ②取代反应 ③水解反应 ④消去反应
(3)B的结构简式是 。
(4)分子式为C7H8O,含有苯环的同分异构体除F外还有 种。
(5)写出下列方程式
① 由A生成B和F: ;
② B → C: ;
③A在一定条件下生成高聚物: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较不正确的是
A. 气态氢化物稳定性HF>HCl>HBr>HI
B. 熔点Rb>K>Na>Li
C. 碱性RbOH>KOH>NaOH>LiOH
D. 还原性Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:
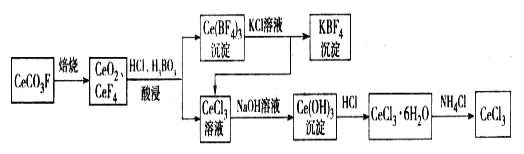
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为_________。
(2)酸浸过程中可用稀硫酸和H2O2替换HCl,优点为____________;写出稀硫酸、H2O2与CeO2反应的离子方程式:______________。
(3)写出Ce(BF4)3中加入KCl溶液反应的离子方程式:__________。
(4)化学家研究发现,SbF5能将MnF4从离子[SbF6]2-的盐反应得到,SbF5转化成稳定离子[SbF6]-的盐。而SbF4很不稳定,受热易分解为SbF3和F2。根据据以上研究写出以K2MnF6和SbF5为原料,在 423 K 的温度下制备F2的化学方程式:______________________。
现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。 已知KHF2是一种酸式盐,写出阴极上发生的电极反应式_______。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
(5)已知25 ℃时,HF的电离平衡常数Ka=3.6×10-4,CaF2的溶解积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在工农业生产、生活中有着重要的作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·molˉ1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
同一条件下,若2molCH4 还原NO2 至N2,生成气态水和二氧化碳。整个过程中放出的热量为1734kJ,则ΔH2=__________;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g) ΔH>0。
2Fe(s)+3CO(g)+6H2(g) ΔH>0。
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为_______。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是_____(填序号)。
A.CH4的转化率等于CO的产率
B.混合气体的密度保持不变
C.速率:2v(CO)=v(H2)
D.固体的总质量保持不变
③该反应达到平衡时某物理量随温度变化如图所示,当压强由P1升高到P2时,平衡常数KA___KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些______。(填序号)

A.H2的逆反应速率
B.CH4的的转化率
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)甲酸是易溶于水的一元弱酸。
①常温下,将1L 0.1mol/L HCOOH溶液与1L0.1mol/LNaOH溶液混合后,下列关系不正确的是____(填序号)。
a.c(H+)水·c(OH-)水=1×10-14 b.2c(H+)+c(HCOOH)=2c(OH-)+c(HCOO-)
c.c(Na+)=c(HCOOH)+c(HCOO-) d.c(HCOO-)>c(Na+)>c(H+)>c(OH-)
②向1L 0.1mol/L HCOONa溶液中加水稀释后,c(HCOOH)/c(HCOO-)的数值______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.

请按要求回答下列问题:
(1)元素③的最高价氧化物对应的水化物的化学式为 ;
(2)②、③两元素的原子半径较大的是 (填元素符号);
(3)④和⑤两种元素的金属性较强的是 (填元素符号);
(4)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
实验装置与现象 | |||
装置 | 甲 | 乙 | 丙 |
|
|
| |
现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
A. 装置甲中的B金属是原电池的负极
B. 装置乙中的C金属是原电池的阴极
C. 装置丙中的D金属是原电池的正极
D. 四种金属的活泼性顺序是D>A>B>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为铁在一定条件下的转化关系图。

请回答:
(1)“曾青得铁则化为铜”的反应有:Fe + CuSO4 = FeSO4 + Cu,该反应的还原剂是_____________(填化学式);
(2)工业上,向500-600℃的铁屑中通入Cl2生产FeCl3,向FeCl3溶液中滴加KSCN溶液,观察到的现象是溶液变成____________色;
(3)图2为原电池装置示意图,此装置可以把化学能转化为_________能,其中铁作_____极;

(4)Fe3O4中Fe既有+2价又有+3价,则+2价和+3价Fe的个数比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com