
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
①3.9g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA
②3.1g氧化钠和3.9g过氧化钠的混合物中含有的阴离子总数为0.1NA
③1.8g14CH4和水蒸气(H216O)的混合气体中含电子数目为NA
④常温下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同
⑤常温下,4.6gNO2和N2O4组成的混合气体中所含原子总数为0.3NA
⑥1mol SiO2晶体中含有极性共价键数目为2NA
⑦将1mol Cl2通入足量水中,溶液中HClO、Cl-、C1O-粒子数之和为2NA
⑧高温下,16.8g Fe与足量水蒸气完全反应转移电子数为0.8NA
A. ①②④⑥ B. ②③⑥⑦ C. ③⑤⑦⑧ D. ②③⑤⑧
【答案】D
【解析】
①苯中不含碳碳双键;②1molNa2O和1molNa2O2中的阴离子均为1mol,计算出所给数据下的物质的量,再计算阴离子数目;③14CH4和H216O(g)的摩尔质量均为18g·mol-1,1.8g该混合气体的物质的量等于0.1mol,二者均含10个电子;④NH4+要发生水解,而且浓度越小,水解程度越大,NH4+的数目不相同;⑤NO2和N2O4混合,相当于体系中只有NO2;⑥1molSiO2晶体中含有极性共价键数目为4NA;⑦Cl2通入足量水中,只有一小部分和水反应,根据物料守恒,含氯的微粒有Cl2、HClO、Cl-、ClO-;⑧Fe与足量水蒸气完全反应生成Fe3O4,Fe3O4可变换为Fe2O3·FeO,既有二价铁,又有三价铁,从而计算转移的电子数。
①苯中不含碳碳双键,苯中的碳碳键是介于双键和单键之间独特的键,故①错误;②3.1g氧化钠的物质的量为3.1g/62g·mol-1=0.05mol,3.9g过氧化钠的物质的量为3.9g/78g·mol-1=0.05mol,氧化钠与过氧化钠中阴离子个数均为1,故二者的混合物中含有的阴离子总数为0.1NA,故②正确;③14CH4和H216O(g)的摩尔质量均为18g·mol-1,1.8g该混合气体的物质的量等于0.1mol,二者均含10个电子,故该混合气体中含电子数目为NA,故③正确;④NH4+要发生水解,而且浓度越小,水解程度越大。1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液中,2L0.25mol·L-1NH4Cl溶液中NH4+的水解程度更大,故NH4+的数目不相等,故④错误;⑤NO2和N2O4混合,相当于体系中只有NO2.4.6g该混合物的物质的量为4.6g/46g·mol-1=0.1mol,一分子NO2中含有3个原子,故所含原子总数为0.3NA,故⑤正确;⑥在SiO2晶体中,1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子,故1molSiO2晶体中含有极性共价键数目为4NA,故⑥错误;⑦Cl2通入足量水中,只有一小部分和水反应,根据物料守恒,含氯的微粒有Cl2、HClO、Cl-、ClO-,故HClO、Cl-、ClO-粒子数之和小于2NA,故⑦错误;⑧Fe与足量水蒸气完全反应生成Fe3O4,Fe+4H2O(g)![]() Fe3O4+4H2,16.8gFe的物质的量为16.8g/56g·mol-1=0.3mol,则生成0.3molFe3O4,Fe3O4可变换为Fe2O3·FeO,即生成0.2mol+3价铁和0.1mol+2价铁,共转移电子0.8NA,故⑧正确。故正确的选项为②③⑤⑧,故选:D。
Fe3O4+4H2,16.8gFe的物质的量为16.8g/56g·mol-1=0.3mol,则生成0.3molFe3O4,Fe3O4可变换为Fe2O3·FeO,即生成0.2mol+3价铁和0.1mol+2价铁,共转移电子0.8NA,故⑧正确。故正确的选项为②③⑤⑧,故选:D。


科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型电池的开发与使用在现代社会中已很普遍,一种水煤气燃料电池的能量转化率可达90%以上。下列说法正确的是
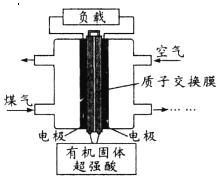
A. 总反应为2CO+O2==2CO2
B. 负极反应为H2-2e—==2H+、CO-2e—+H2O==CO2+2H+
C. 电路中通过4 mol电子,正极消耗22.4 L(标准状况)空气
D. 有机固体中的H+在放电时向正极移动,造成正极pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______族
(2)下列关于Ge元素叙述正确的是______(从下列选项中选择)
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________
(4)NH3也常作致冷剂,其键角_______(填“大于”或“小于”)109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是___________________________
(5)图示材料的理想化学式(无空位时)为___________________,若Y(钇)元素的化合价为+3,则Cu的平均化合价为_______
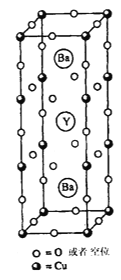
(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为________ (只含一个系数,用a、ρ、NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为______________________________,工艺师常用________(填物质名称)来雕刻玻璃。
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可作________的原料。
(3)工业上常用2C+SiO2![]() Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是________(填化学式,下同),氧化剂是________。
Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是________(填化学式,下同),氧化剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |

图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
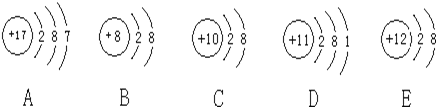
(1)属于离子结构示意图的是______、______(填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同)______,最容易失去电子的原子是______,最容易得到电子的原子是______。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式______。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年11月30日第21届联合国气候大会在巴黎召开,会议的一项主题是温室气体减排。如图是科学家正在研发的实现CO2和H2合成甲醇的燃烧电池。下列叙述正确的是
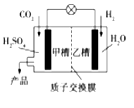
A.乙槽中反应生成水
B.甲槽中的电极反应式为:CO2+6e-+5H2O=CH3OH+6OH-
C.质子从乙槽通过质子交换膜进入甲槽
D.放电过程中,乙槽的电极附近溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
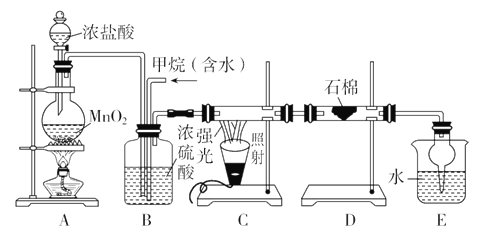
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③____________。
(2)D装置的石棉中均匀混有KI粉末,其作用是_______________。
(3)E装置的作用是________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出生成黑色小颗粒的化学方程式_________________________________________________________。
(5)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com