
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
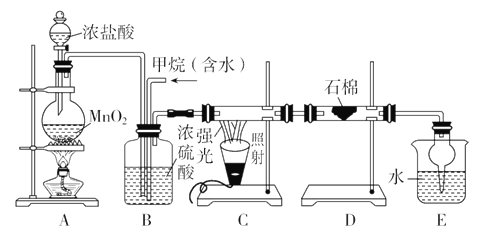
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③____________。
(2)D装置的石棉中均匀混有KI粉末,其作用是_______________。
(3)E装置的作用是________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出生成黑色小颗粒的化学方程式_________________________________________________________。
(5)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
【答案】干燥混合气体吸收过量的氯气CDCH4+2Cl2![]() C+4HCl'分液ab
C+4HCl'分液ab
【解析】
(1)浓硫酸可以干燥氯气和氯化氢;(2)氯气能将碘化钾氧化为碘单质;(3)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要放倒吸;(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒为炭黑,说明有碳生成;(5)甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;一氯甲烷是气体,还可能有过量的甲烷
(1)B装置的三个作用为:①控制气流速度从而达到合适的反应比例;②均匀混合气体,便于后续实验;③干燥混合气体。
(2) 氯气具有强氧化性,能将碘离子氧化生成碘单质,KI的作用是吸收多余的Cl2,防止过量的氯气排入空气中污染环境,反应的化学方程式为Cl2+2KI=2KCl+I2。
(3)E装置既吸收反应生成的HCl气体,同时还防止倒吸。
(4)据信息可知生成的黑色小颗粒为炭黑,说明在强光照射下可发生根据原子守恒应为CH4+2Cl2![]() C+4HCl。
C+4HCl。
(5)最后从D中分离出的气体有HCl易溶于水,可用分液的方法分离,分离难溶于水的油状液体可用分液法。


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
①3.9g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA
②3.1g氧化钠和3.9g过氧化钠的混合物中含有的阴离子总数为0.1NA
③1.8g14CH4和水蒸气(H216O)的混合气体中含电子数目为NA
④常温下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同
⑤常温下,4.6gNO2和N2O4组成的混合气体中所含原子总数为0.3NA
⑥1mol SiO2晶体中含有极性共价键数目为2NA
⑦将1mol Cl2通入足量水中,溶液中HClO、Cl-、C1O-粒子数之和为2NA
⑧高温下,16.8g Fe与足量水蒸气完全反应转移电子数为0.8NA
A. ①②④⑥ B. ②③⑥⑦ C. ③⑤⑦⑧ D. ②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO![]() 、OH-、Cl-、CO
、OH-、Cl-、CO![]() 、Xn-(n=1或2)中的一种。
、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是_____和_____。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br- B.CH3COO- C.SO![]() D.HCO
D.HCO![]()
(3)将38.4 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的________(填相应的离子符号),写出Cu溶解的离子方程式____________________________________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是_____________。
(4)E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe和Fe2O3组成的6.56 g混合物中加入100 mL某浓度的盐酸,恰好完全反应,生成896mLH2(标准状况下),若向反应后的溶液中滴入几滴KSCN溶液,溶液不呈红色。求:
(1)原混合物中Fe2O3的质量分别为______,Fe的质量为________。
(2)原盐酸的物质的量浓度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
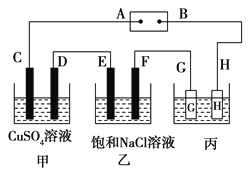
(1)电极A是__________________(填“正极”或“负极”)。
(2)甲装置中电解反应的总化学方程式是_______________。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH=__________________。
(4)欲用丙装置给铜镀银。G应该是___(填“银”或“铜”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. 钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣=Fe2+
B. HS﹣的水解方程式:HS﹣+H2O![]() S2﹣+H3O+
S2﹣+H3O+
C. CO32﹣的水解方程式:CO32﹣+H2O![]() HCO3﹣+OH﹣
HCO3﹣+OH﹣
D. AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是
A. 0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl与0.l mol·L-1氨水等体积混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置及药品制取氨气。

(1)A中制氨气的化学方程式是______。
(2)B中碱石灰的作用是______。
(3)C处是用集气瓶收集氨气的装置,请绘出装置图。______
(4)证明氨气已集满的操作和现象是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com