
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为______________________________,工艺师常用________(填物质名称)来雕刻玻璃。
(2)用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可作________的原料。
(3)工业上常用2C+SiO2![]() Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是________(填化学式,下同),氧化剂是________。
Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是________(填化学式,下同),氧化剂是________。
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_______________。
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:________________(用离子方程式表示)。溶液中所含离子浓度由大到小的顺序为______________。
(4)YX4M的电子式为______________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为_________________________________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量NaHCO3和Na2O的固体混合物溶于适量的水,将所得溶液分成两等份,向其中一份水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份水溶液中加入过量Ba(OH)2溶液,得到白色沉淀39.4g。试回答下列问题:

(1)盐酸的物质的量浓度为___________;
(2)固体混合物中NaHCO3与Na2O物质的量之比_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、氮氧化物等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1) 用CaSO4代替O2与燃料CO反应,是一种高效、清洁、经济的新型燃烧技术,既可提高燃烧效率,又能得到较纯的CO2,以便于被处理。反应①为主反应,反应②和③为副反应。
ⅰ.CaSO4(s)+4CO(g)==CaS(s)+4CO2(g) ΔH1=-189.2 kJ·mol-1
ⅱ.CaSO4(s)+CO(g)==CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
ⅲ.CO(g)==![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)==CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=_________________
(2)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=___________________________________;
②30 min后只改变某一条件,反应达新平衡,根据上表数据判断改变的条件可能是____(选填字母);
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,则Q_____0 (填“>”、“=”或“<”)。
(4)利用如图所示电解装置(电极均为惰性电极)也可吸收SO2,并用阴极室排出的溶液吸收NO2。与电源b极连接的电极的电极反应式为____________________________________。
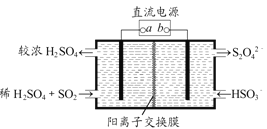
(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周环反应是一类同时成键与断键的反应,经典的周环反应有Diels-Alder反应![]() 、电环化反应(electrocyclic reaction):
、电环化反应(electrocyclic reaction):![]() 等。
等。
已知:![]() ,其中R1、R2、R3为烷基。
,其中R1、R2、R3为烷基。
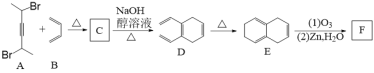
现有一种五元环状内酯I的合成路线如下(A~I均表示一种有机化合物):
![]()
回答下列问题:
(1)化合物A中含有的官能团名称是_____________,D的分子式为________
(2)由C生成D的反应类型为_____________,A形成高聚物的结构简式为__________________
(3)由F生成G的化学方程式为____________________________________________
(4)化合物H的系统命名为_________________
(5)化合物I的质谱表明其相对分子质量为142,I的核磁共振氢谱显示为2组峰,I的结构简式为________________________
(6)在化合物I的同分异构体中能同时符合下列条件的是____________(填写结构简式)
① 具有酚结构;② 仅有一种官能团;③ 具有4种等效氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
①3.9g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA
②3.1g氧化钠和3.9g过氧化钠的混合物中含有的阴离子总数为0.1NA
③1.8g14CH4和水蒸气(H216O)的混合气体中含电子数目为NA
④常温下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同
⑤常温下,4.6gNO2和N2O4组成的混合气体中所含原子总数为0.3NA
⑥1mol SiO2晶体中含有极性共价键数目为2NA
⑦将1mol Cl2通入足量水中,溶液中HClO、Cl-、C1O-粒子数之和为2NA
⑧高温下,16.8g Fe与足量水蒸气完全反应转移电子数为0.8NA
A. ①②④⑥ B. ②③⑥⑦ C. ③⑤⑦⑧ D. ②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A在空气中燃烧生成淡黄色固体;B为红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。
根据以上信息回答下列问题:
(1)写出对应化学式:A______,B______,C______,D______。
(2)A在室温下与氧气反应时生成__________(写化学式,下同),D在空气中锈蚀生成__________。
(3)写出下列化学方程式:
①A在空气中燃烧______________________;
②B与氧气在加热条件下反应______________________;
③C在氧气中燃烧________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
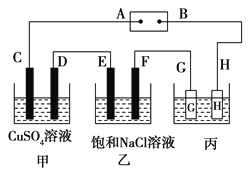
(1)电极A是__________________(填“正极”或“负极”)。
(2)甲装置中电解反应的总化学方程式是_______________。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH=__________________。
(4)欲用丙装置给铜镀银。G应该是___(填“银”或“铜”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com