
【题目】下列反应中,既属于氧化还原反应,同时又是吸热反应的是( )
A. Ba(OH)2·8H2O与NH4Cl反应 B. 灼热的炭与CO2反应
C. 铝与稀盐酸 D. H2与O2的燃烧反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是

A. 1mol NH4+ 所含的质子总数为10NA
B. 1mol联氨(N2H4)中含有5mol共价键
C. 1molNH4+经过过程I、II、III,(假设每步转化均完全)得到氮气的体积约为11.2L
D. 该方法每处理1molNH4+,需要的NO2—为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
I.岩脑砂的制备
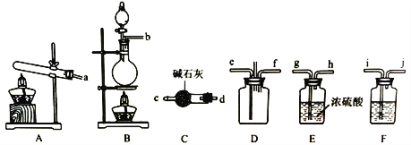
(1)该实验中用浓盐酸与二氧化锰反应制取所需氯气,写出该反应的离子方程式____________
(2)确定上述装置的合理连接顺序:a→____→ef←___(用小写字母和箭头表示,箭头方向与气流方向一致)。
(3)装置F中试剂的作用为___________
(4)装置D处有两个明显的不足之处,其中之一为:导管太细,生成的氯化铵固体可能会堵塞导管,之二为:___________。
II.岩脑砂中元素的测定:准确称取ag岩脑砂,与足量的氧化铜混合加热,利用右图装置测定岩脑砂中氮元素和氯元素的质量之比。充分加热后,G中产生红色固体,H、I装置质量增加,K中收集到无色气体。
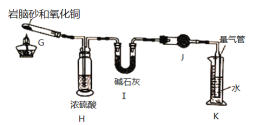
(5)写出G中发生反应的方程式______________________________________________
(6)若没有H装置,会导致测量值_____________(填“偏高”,“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构和化学用语的说法正确的是( )
A. 39 g Na2O2晶体中所含阴、阳离子总数为2NA
B. 1个氮气分子中存在3对共用电子对
C. NaOH和Na2O中所含的化学键类型完全相同
D. AlCl3和MgF2中都含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。 下列说法正确的是 ( )
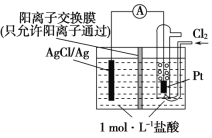
A. 正极反应为AgCl+e-=Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.02 mol e- 时,交换膜左侧溶液中约减少0.04 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应表达正确的是 ( )
A. 1—丙醇与浓氢溴酸反应:CH3CH2CH2OH + HBr ![]() CH3CH2CH2Br + H2O
CH3CH2CH2Br + H2O
B. 硬脂酸与乙醇的酯化反应:C17H35COOH + C2H518OH ![]() C17H35COOC2H5 + H218O
C17H35COOC2H5 + H218O
C. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH + OH— ![]() CH2BrCOO— + H2O
CH2BrCOO— + H2O
D. 向丙氨酸钠中加入足量盐酸: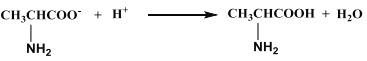
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:

已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为________,实验室配制氯化铝溶液时加入盐酸的目的是________________________。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为______________________炉气中残余有少量Cl2,请画出吸收Cl2的尾气装置图_____。

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________________。
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() n克Al2O3
n克Al2O3
NaAlO2溶液与过量二氧化碳反应的离子方程式为:______________________。计算该样品中Al的质量分数________(结果用m、n表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
A. KClO3发生化合价降低,失电子
B. 反应中H2SO4体现了酸性和强氧化性
C. 反应中H2C2O4被氧化
D. 产物中Cl与C化合价相同,因而氧化性一样强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
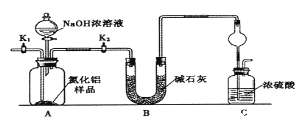
(1)如图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先______;再加入实验药品。接下来的实验操作是____,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_________。
(方案2)用如下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
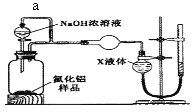
(4)导管a的主要作用是______________。
(5)为测定生成气体的体积,量气装置中的X液体可以是____________。(填选项序号)
a.CCl4 b.H2O c.NH4Cl溶液 d.![]()
(6)若mg样品完全反应,测得生成气体的体积为VmL,(已转换为标准状况),则A1N的质量分数为___(用含V、m的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com