
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。 下列说法正确的是 ( )
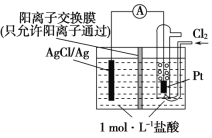
A. 正极反应为AgCl+e-=Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.02 mol e- 时,交换膜左侧溶液中约减少0.04 mol离子
【答案】D
【解析】
根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A.正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B.放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧溶液中有大量白色沉淀生成,故B错误;
C.根据电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;
D.放电时,当电路中转移0.01mole-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如图所示的关系:
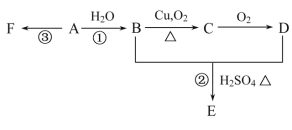
(1)A的分子式为_____,用途为____________________。
(2)写出反应①的化学方程式_____________________,该反应的类型是______。
写出反应②的化学方程式___________________,该反应的类型是_________。
写出反应③的化学方程式____________________________。
(3)写出B生成C的方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝是重要的金属材料,铁、铝及其化合物有非常重要的用途。
(1)下列说法正确的是________(填序号)。
① 配制氯化铁溶液,先将FeCl3固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
② FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③ 利用氯水和KSCN溶液可以检验Fe3+中有无Fe2+
④ 加热蒸干Fe2(SO4)3溶液获得Fe2(SO4)3固体
⑤ 含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成Al(OH) 3的质量相等
⑥ 由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。其作用原理为__________________。
(3)以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝的一种工艺流程如下:
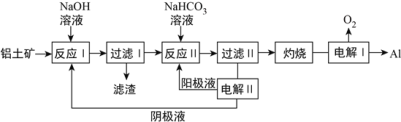
①滤渣主要成分为___________________
②在实验室灼烧操作应选择的实验仪器为_____________________
③反应II中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式________。
(4)已知25 ℃时Ksp[Cu(OH)2]=2.2×1020,Ksp[Fe(OH)3]=4.0×1038, Ksp[Al(OH)3]=1.1×1033。
①在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×105 mol·L1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 ![]() 的分子式均为C8H8,下列说法不正确的是 ( )
的分子式均为C8H8,下列说法不正确的是 ( )
A. 甲、乙、丙的二氯代物数目最少的是丙
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 甲、乙、丙在空气中燃烧时均产生明亮并带有浓烟的火焰
D. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起世界各国的广泛重视。在爆炸的核电站周围含有放射性物质碘131和铯137。碘131一旦被人体吸入,可能会引发甲状腺疾病。
(1)Cs(铯)的价电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ·mol-1) | 520 | 496 | 419 |
上述三种元素X、Y、Z的元素符号分别为________,基态Z原子的核外电子排布式为________,X形成的单质晶体中含有的化学键类型是________。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为________、________,BeF2分子的立体构型是________,H2O分子的立体构型是________。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BCl3分子中B—Cl键的键角为________。
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有________个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻________个I-。

甲 乙
(5)KI晶体的密度为ρ g·cm-3,K和I的摩尔质量分别为MK g·mol-1和MIg·mol-1,原子半径分别为rKpm和rIpm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,同时又是吸热反应的是( )
A. Ba(OH)2·8H2O与NH4Cl反应 B. 灼热的炭与CO2反应
C. 铝与稀盐酸 D. H2与O2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是( )
A. 反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B. 用铁片与稀硫酸反应制H2,改用98%的浓硫酸可加快生成H2的速率
C. 用锌片与稀盐酸反应,加入适量的NaCl溶液,反应速率不变
D. 反应2SO2(s)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关“未来金属”钛的信息有:①硬度大②熔点高③常温下耐酸碱、耐腐蚀④铁矿炼钛的一种工业流程为:
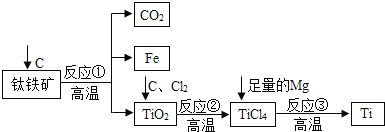
(1)钛铁矿的主要成分是FeTiO3(钛酸亚铁),其中钛的化合价为_______价,反应①化学方程式为_____________
(2)TiCl4在高温下与足量Mg反应生成金属Ti,反应③化学方程式为_________,属于______(填反应类型),该反应_____(填“能”或“不能”)说明Mg的金属活动性强于Ti.
(3)上述冶炼方法得到的金属钛中会混有少量金属单质是______(填名称),由前面提供的信息 ______(填序号)知,除去它的试剂可以是以下试剂中的_________(填序号)
A:HClB:NaOHC:NaClD:H2SO4
(4)氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2 ====2TiCl4+2X+6CO,则X的化学式为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3 与稀硫酸反应的化学方程式为__________________________。
(2)加入H2O2 氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是___________(填化学式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com