
【题目】无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:

已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为________,实验室配制氯化铝溶液时加入盐酸的目的是________________________。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为______________________炉气中残余有少量Cl2,请画出吸收Cl2的尾气装置图_____。

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________________。
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() n克Al2O3
n克Al2O3
NaAlO2溶液与过量二氧化碳反应的离子方程式为:______________________。计算该样品中Al的质量分数________(结果用m、n表示,不必化简)。
【答案】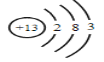 防止Al3+水解Al2O3+3Cl2+3C
防止Al3+水解Al2O3+3Cl2+3C![]() 3CO+2AlCl3
3CO+2AlCl3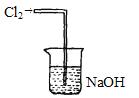 bAlO2-+CO2+2H2O=Al(OH)3↓+HCO3-27n/51m
bAlO2-+CO2+2H2O=Al(OH)3↓+HCO3-27n/51m
【解析】
铝土和焦炭矿焙烧炉中加热, Fe2O3被还原得到Fe,所以反应后得到Al2O3和Fe,加入Cl2、焦炭在氯化炉中反应,Fe、Al2O3、Cl2和C反应会生成AlCl3、FeCl3、CO,排出废气CO和Cl2,加入Al粉除去FeCl3、Fe,最后得到 AlCl3,冷凝得到AlCl3固体;据以上分析解答。
铝土和焦炭矿焙烧炉中加热, Fe2O3被还原得到Fe,所以反应后得到 Al2O3和Fe,加入Cl2、焦炭在氯化炉中反应,Fe、Al2O3、Cl2和C反应会生成AlCl3、FeCl3、CO,排出废气CO和Cl2,加入Al粉除去FeCl3、Fe,最后得到 AlCl3,冷凝得到AlCl3固体;
(1)铝原子核电荷数为13,,原子结构示意图为 ;氯化铝溶液水解显酸性,配制氯化铝溶液时加入盐酸来抑制铝离子的水解;综上所述,本题答案是:
;氯化铝溶液水解显酸性,配制氯化铝溶液时加入盐酸来抑制铝离子的水解;综上所述,本题答案是: ;防止Al3+水解。
;防止Al3+水解。
(2)根据以上分析可知,氯化炉中Al2O3、Cl2和焦炭在高温下发生反应,生成AlCl3、CO,化学方程式为:Al2O3+3Cl2+3C![]() 3CO+2AlCl3;Cl2有毒,污染空气,可用氢氧化钠溶液来吸收;吸收Cl2的尾气装置图为:
3CO+2AlCl3;Cl2有毒,污染空气,可用氢氧化钠溶液来吸收;吸收Cl2的尾气装置图为: ;综上所述,本题答案是:Al2O3+3Cl2+3C
;综上所述,本题答案是:Al2O3+3Cl2+3C![]() 3CO+2AlCl3;
3CO+2AlCl3; 。
。
(3)已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华;所以降温实现FeCl3和AlCl3的分离,合适的温度范围为介于183 ℃和315 ℃之间;综上所述,本题答案是:b。
(4)NaAlO2溶液与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。根据流程可知,ngAl2O3的物质的量为n/102mol,根据铝元素守恒:2n(AlCl3)=n(Al2O3),n(Al)=n(AlCl3)=2×n/102mol=n/51mol,铝元素质量为n/51×27g=27n/51 g;所以样品中Al的质量分数(27n/51)/m×100%=27n/51m;综上所述,本题答案是: AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;27n/51m。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为
A. Vd/(MV+2240)mol/LB. 1000Vd/(MV+2240)mol/L
C. VdM/(MV+2240)mol/LD. VM/22.4(V+0.1)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 ![]() 的分子式均为C8H8,下列说法不正确的是 ( )
的分子式均为C8H8,下列说法不正确的是 ( )
A. 甲、乙、丙的二氯代物数目最少的是丙
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 甲、乙、丙在空气中燃烧时均产生明亮并带有浓烟的火焰
D. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,同时又是吸热反应的是( )
A. Ba(OH)2·8H2O与NH4Cl反应 B. 灼热的炭与CO2反应
C. 铝与稀盐酸 D. H2与O2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是( )
A. 反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B. 用铁片与稀硫酸反应制H2,改用98%的浓硫酸可加快生成H2的速率
C. 用锌片与稀盐酸反应,加入适量的NaCl溶液,反应速率不变
D. 反应2SO2(s)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关“未来金属”钛的信息有:①硬度大②熔点高③常温下耐酸碱、耐腐蚀④铁矿炼钛的一种工业流程为:
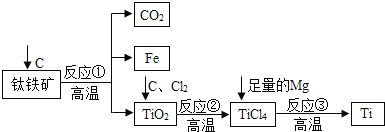
(1)钛铁矿的主要成分是FeTiO3(钛酸亚铁),其中钛的化合价为_______价,反应①化学方程式为_____________
(2)TiCl4在高温下与足量Mg反应生成金属Ti,反应③化学方程式为_________,属于______(填反应类型),该反应_____(填“能”或“不能”)说明Mg的金属活动性强于Ti.
(3)上述冶炼方法得到的金属钛中会混有少量金属单质是______(填名称),由前面提供的信息 ______(填序号)知,除去它的试剂可以是以下试剂中的_________(填序号)
A:HClB:NaOHC:NaClD:H2SO4
(4)氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2 ====2TiCl4+2X+6CO,则X的化学式为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(二)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池足一种新型的绿色环保储能电池。其电池总反应为:V3++VO2++H2O ![]() VO2++2H++V2+,下列说法正确的是
VO2++2H++V2+,下列说法正确的是
A.放电时正极反应为:VO2++2H++e-=VO2++H2O
B.充电时阴极反应为:V2+-e-=V3+
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com